题目内容
短周期元素X、Y、Z、W在周期表中的位置关系如图所示,则下列叙述中错误的是( )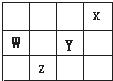

| A、四元素中,X的单质最稳定 |
| B、氢化物稳定性:HY>H2Z |
| C、原子半径:W>Y |
| D、W在周期表中的位置为:第2周期第5族 |
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由短周期元素X、Y、Z、W在周期表中的位置,可知X为He、Y为F元素、W为N元素、Z为S元素.
A.稀有气体最稳定;
B.非金属性越强,氢化物越稳定;
C.同周期自左而右原子半径减小;
D.W处于第二周期第ⅤA族.
A.稀有气体最稳定;
B.非金属性越强,氢化物越稳定;
C.同周期自左而右原子半径减小;
D.W处于第二周期第ⅤA族.
解答:
解:由短周期元素X、Y、Z、W在周期表中的位置,可知X为He、Y为F元素、W为N元素、Z为S元素.
A.X是稀有气体He,性质最稳定,故A正确;
B.非金属性F>S,非金属性越强,氢化物越稳定,故氢化物稳定性:HF>H2S,故B正确;
C.同周期自左而右原子半径减小,故原子半径:W>Y,故C正确;
D.W为N元素,处于第二周期第ⅤA族,故D错误,
故选D.
A.X是稀有气体He,性质最稳定,故A正确;
B.非金属性F>S,非金属性越强,氢化物越稳定,故氢化物稳定性:HF>H2S,故B正确;
C.同周期自左而右原子半径减小,故原子半径:W>Y,故C正确;
D.W为N元素,处于第二周期第ⅤA族,故D错误,
故选D.
点评:本题考查元素周期表与元素周期律,难度不大,侧重对元素周期律的考查,注意对基础知识的理解掌握.

练习册系列答案
相关题目
下列各化合物的命名中不正确的是( )
| A、CH2=CH-CH=CH2 1,3-丁二烯 |
B、 3-丁醇 3-丁醇 |
C、 邻-甲基苯酚 邻-甲基苯酚 |
D、 2-甲基丁烷 2-甲基丁烷 |
下列离子方程式正确的是( )
| A、工业制取漂白粉:2Cl2+4OH-=2Cl-+2ClO-+2H2O | ||
B、向NaOH溶液中滴加同浓度的少量Ca(HCO3)2溶液:Ca2++HCO
| ||
| C、硫酸亚铁加过氧化氢溶液:Fe2++H2O2+2H+═Fe3++4H2O | ||
| D、铝粉与NaOH的D2O溶液反应:2Al+2OH-+2D2O═2AlO2-+3D2↑ |
在海洋底部存在大量称为“可燃冰”的物质,其蕴藏量是地球上煤、石油的几百倍,因而是一种等待开发的巨大能源物质.初步查明可燃冰是甲烷、乙烷等可燃性气体的水合物.有关可燃冰的下述推测中不正确的是( )
| A、高压、低温有助于可燃冰的形成 |
| B、构成可燃冰的原子间存在极性共价键 |
| C、可燃冰的微粒间可能存在一种比范德华力更强的相互作用力 |
| D、常温、常压下可燃冰是一种稳定的物质 |
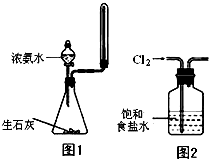 下列有关实验没有明显错误的是( )
下列有关实验没有明显错误的是( )| A、使用湿润过的pH试纸测量某溶液的pH |
| B、实验室可以用图1所示装置来制取少量氨气 |
| C、用量筒量取20 mL 0.50mol?L-1H2SO4溶液于烧杯中,加水80 mL,配制成0.10mol?L-1H2SO4溶液 |
| D、实验室用图2所示装置除去Cl2中的少量HCl |
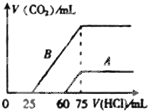 向10mL某浓度的NaOH溶液中通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同.若向M中逐滴加入0.1mol/L盐酸,产生的气体V(CO2)与加入盐酸的体积V(HCl)的关系有图示两种情况,则下列分析判断不正确的是(不考虑CO2的溶解)( )
向10mL某浓度的NaOH溶液中通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同.若向M中逐滴加入0.1mol/L盐酸,产生的气体V(CO2)与加入盐酸的体积V(HCl)的关系有图示两种情况,则下列分析判断不正确的是(不考虑CO2的溶解)( )| A、曲线A表明M中的溶质为NaOH、Na2CO3 |
| B、曲线B表明M中NaHCO3与Na2CO3的物质的量之比为1:2 |
| C、原NaOH溶液的物质的量浓度为0.75mol/L |
| D、由A.B可知,两次实验通入的CO2的体积比3:10 |
下列关于卤素及其化合物的叙述正确的是( )
| A、HF水溶液可存放在玻璃试剂瓶中 |
| B、Br2可从KCl溶液中置换出氯 |
| C、F、Cl、Br、I的非金属性依次减弱 |
| D、HF、HCl、HBr、HI的稳定性依次增强 |
将0.05 mol?L-1的醋酸溶液加水稀释时,下列说法正确的是( )
| A、溶液中氢氧根离子的浓度增大了 |
| B、c(CH3COOH)减小,电离平衡向生成醋酸分子的方向移动? |
| C、平衡向电离的方向移动,氢离子的浓度增大,醋酸分子的数量减少 |
| D、电离程度增大,c(CH3COO-)也增大了 |