题目内容
已知:甲醇脱水反应2CH3OH(g)=CH3OCH3(g)+H2O(g)△H1=-23.9KJ?mol-1
甲醇制烯烃反应2CH3OH(g)=C2H4(g)+2H2O(g)△H2=-29.1KJ?mol-1
乙醇异构化反应CH3CH2OH(g)=CH3OCH3(g)△H3=+50.7KJ?mol-1
则乙烯气向直接水合反应
C2H4(g)+H2O(g)=C2H5OH(g)的△H= .
甲醇制烯烃反应2CH3OH(g)=C2H4(g)+2H2O(g)△H2=-29.1KJ?mol-1
乙醇异构化反应CH3CH2OH(g)=CH3OCH3(g)△H3=+50.7KJ?mol-1
则乙烯气向直接水合反应
C2H4(g)+H2O(g)=C2H5OH(g)的△H=
考点:用盖斯定律进行有关反应热的计算
专题:化学反应中的能量变化
分析:利用盖斯定律构造目标热化学方程式并求焓变.
解答:
解:已知:已知:甲醇脱水反应①2CH3OH(g)=CH3OCH3(g)+H2O(g)?△H1=-23.9KJ?mol-1
甲醇制烯烃反应②2CH3OH(g)=C2H4 (g)+2H2O(g)?△H2=-29.1KJ?mol-1
乙醇异构化反应③CH3CH2OH(g)=CH3OCH3(g))?△H3=+50.7KJ?mol-1,
根据盖斯定律①-②-③可得:C2H4(g)+H2O(g)═C2H5OH(g)△H=(-23.9+29.1-50.7)kJ/mol=-45.5kJ/mol,
故答案为:-45.5 kJ?mol-1.
甲醇制烯烃反应②2CH3OH(g)=C2H4 (g)+2H2O(g)?△H2=-29.1KJ?mol-1
乙醇异构化反应③CH3CH2OH(g)=CH3OCH3(g))?△H3=+50.7KJ?mol-1,
根据盖斯定律①-②-③可得:C2H4(g)+H2O(g)═C2H5OH(g)△H=(-23.9+29.1-50.7)kJ/mol=-45.5kJ/mol,
故答案为:-45.5 kJ?mol-1.
点评:本题考查盖斯定律的应用,为高频考点,侧重分析能力及计算能力的考查,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列溶液中有关物质的量浓度关系不正确的( )
| A、pH=2的HA溶液与pH=12的MOH溶液以任意比混合:c(H+)+c(M+)=c(OH-)+c(A-) |
| B、0.1mol?L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(A2-)>c(H2A) |
| C、物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH) |
| D、pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) |
下面均是正丁烷与氧气反应的热化学方程式(25°,101kPa):
①C4H10(g)+
O2(g)=4CO2(g)+5H2O(l)△H=-2878kJ/mol
②C4H10(g)+
O2(g)=4CO2(g)+5H2O(g)△H=-2658kJ/mol
③C4H10(g)+
O2(g)=4CO(g)+5H2O(l)△H=-1746kJ/mol
④C4H10(g)+
O2(g)=4CO(g)+5H2O(g)△H=-1526kJ/mol
由此判断,正丁烷的燃烧热是( )
①C4H10(g)+
| 13 |
| 2 |
②C4H10(g)+
| 13 |
| 2 |
③C4H10(g)+
| 9 |
| 2 |
④C4H10(g)+
| 9 |
| 2 |
由此判断,正丁烷的燃烧热是( )
| A、-2878kJ/mol |
| B、-2658kJ/mol |
| C、-1746kJ/mol |
| D、-1526kJ/mol |
化学与生产、生活、社会密切相关,下列说法错误的是( )
| A、油脂发生皂化反应能生成甘油 |
| B、蔗糖及其水解产物均能与新制氢氧化铜反应生成红色沉淀 |
| C、实验室可以使用CuSO4溶液除去乙炔中的H2S等杂质 |
| D、甲烷、苯、乙醇、乙酸和乙酸乙酯都可以发生取代反应 |
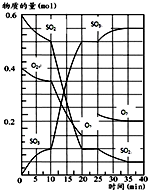 500℃时,将SO2和O2置于一容积固定为2L的密闭容器中发生反应,反应过程中SO2、O2和SO3物质的量变化如图所示.
500℃时,将SO2和O2置于一容积固定为2L的密闭容器中发生反应,反应过程中SO2、O2和SO3物质的量变化如图所示.
