题目内容
现有100mL的Al2(SO4)3、MgSO4混合溶液,其中c(Mg2+)=0.5mol/L,c(SO42-)=2.0mol/L,向其中加入10.35g金属钠,并不断搅拌使之充分反应,使计算:
(1)产生的气体在标准情况下的体积.
(2)原混合溶液中Al3+的物质的量浓度.
(3)反应后所得沉淀的物质的量分别是多少?
(1)产生的气体在标准情况下的体积.
(2)原混合溶液中Al3+的物质的量浓度.
(3)反应后所得沉淀的物质的量分别是多少?
考点:有关混合物反应的计算
专题:计算题
分析:(1)Na与水反应生成氢氧化钠与氢气,根据n=
计算Na的物质的量,根据电子转移守恒计算生成氢气的物质的量,再根据V=nVm计算氢气的体积;
(2)根据电荷守恒有:2c(Mg2+)+3c(Al3+)=2c(SO42-);
(3)生成的氢氧化钠又发生反应:Mg2++2OH-═Mg(OH)2↓、Al3++3OH-═Al(OH)3↓,然后发生反应Al(OH)3+OH-═AlO2-+2H2O,结合方程式计算.
| m |
| M |
(2)根据电荷守恒有:2c(Mg2+)+3c(Al3+)=2c(SO42-);
(3)生成的氢氧化钠又发生反应:Mg2++2OH-═Mg(OH)2↓、Al3++3OH-═Al(OH)3↓,然后发生反应Al(OH)3+OH-═AlO2-+2H2O,结合方程式计算.
解答:
解:(1)Na的物质的量为
=0.45mol,Na与水反应生成氢氧化钠与氢气,根据电子转移守恒,生成氢气的物质的量为
=0.225mol,标况下氢气的体积为0.225mol×22.4L/mol=5.04L,
答:标况下生成氢气的体积为5.04L;
(2)根据电荷守恒有:2c(Mg2+)+3c(Al3+)=2c(SO42-),则:2×0.5mol/L+3c(Al3+)=2×2mol/L,解得c(Al3+)=1mol/L,
答:原混合溶液中Al3+的物质的量浓度为1mol/L;
(3)由钠元素守恒,生成NaOH为0.45mol,溶液中n(Mg2+)=0.1L×0.5mol/L=0.05mol,n(Al3+)=0.1L×1mol/L=0.1mol,
Mg2++2 OH-═Mg(OH)2↓
0.05mol 0.1mol 0.05mol
Al3++3 OH-═Al(OH)3↓
0.1mol 0.3mol 0.1mol
剩余NaOH为0.45mol-0.1mol-0.3mol=0.05mol
Al(OH)3+OH-═AlO2-+2H2O
0.05mol 0.05mol
故溶解的氢氧化铝为0.05mol,得到氢氧化铝为0.1mol-0.05mol=0.05mol,
故最终得到沉淀中有0.05mol Mg(OH)2,0.05mol Al(OH)3,
答:最终得到沉淀中有0.05mol Mg(OH)2,0.05mol Al(OH)3.
| 10.35g |
| 23g/mol |
| 0.45mol×1 |
| 2 |
答:标况下生成氢气的体积为5.04L;
(2)根据电荷守恒有:2c(Mg2+)+3c(Al3+)=2c(SO42-),则:2×0.5mol/L+3c(Al3+)=2×2mol/L,解得c(Al3+)=1mol/L,
答:原混合溶液中Al3+的物质的量浓度为1mol/L;
(3)由钠元素守恒,生成NaOH为0.45mol,溶液中n(Mg2+)=0.1L×0.5mol/L=0.05mol,n(Al3+)=0.1L×1mol/L=0.1mol,
Mg2++2 OH-═Mg(OH)2↓
0.05mol 0.1mol 0.05mol
Al3++3 OH-═Al(OH)3↓
0.1mol 0.3mol 0.1mol
剩余NaOH为0.45mol-0.1mol-0.3mol=0.05mol
Al(OH)3+OH-═AlO2-+2H2O
0.05mol 0.05mol
故溶解的氢氧化铝为0.05mol,得到氢氧化铝为0.1mol-0.05mol=0.05mol,
故最终得到沉淀中有0.05mol Mg(OH)2,0.05mol Al(OH)3,
答:最终得到沉淀中有0.05mol Mg(OH)2,0.05mol Al(OH)3.
点评:本题考查混合物有关计算、镁铝化合物性质,(2)中注意利用电荷守恒计算,(3)中关键是明确发生的反应,难度中等.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
 含有一个碳碳双键的烯烃,加氢后产物的结构简式为如图,这种烯烃可能的结构有(不考虑立体异构)( )
含有一个碳碳双键的烯烃,加氢后产物的结构简式为如图,这种烯烃可能的结构有(不考虑立体异构)( )| A、5种 | B、6种 | C、7种 | D、8种 |
下列有关实验的叙述中正确的是( )
| A、中和热的测定和蒸馏均需要温度计,且温度计水银球均插入反应液中 |
| B、中和热的测定和过滤均需要玻璃棒,且玻璃棒的作用均是引流 |
| C、中和热的测定和中和滴定,均是将一种反应物逐滴滴加到另一种反应物中 |
| D、中和热的测定实验中用60mL 0.50mol?L-1盐酸和50 mL0.55mol?L-1 NaOH溶液反应,与用50mL 0.50mol?L-1 盐酸和50ml 0.55mol?L-1 NaOH溶液反应所求中和热的数值相等 |
下列反应的离子方程式正确的是( )
| A、澄清的石灰水跟盐酸反应:H++OH-═H2O |
| B、铁和稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ |
| C、NaHCO3溶液与NaOH溶液反应:OH-+HCO3-=CO32-+H2O |
| D、金属钠跟水反应:Na+2H2O═Na++2OH-+H2↑ |

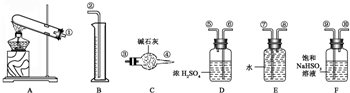
 +R′-CH2-CHO→
+R′-CH2-CHO→ (其中R、R′为烃基,也可以是氢原子)产物不稳定,受热易脱水而生成不饱和醛.
(其中R、R′为烃基,也可以是氢原子)产物不稳定,受热易脱水而生成不饱和醛.