题目内容
燃料电池是当前研究的一个热点.回答下列有关问题:
(1)某甲醚燃料电池结构如图1,写出该电池工作时负极的电极反应式 .如图2为熔融碳酸盐燃料电池的工作原理示意图.该熔融碳酸盐燃料电池工作过程中消耗的反应物是 ,正极的电极反应可表示为 .

(2)氢氧燃料电池是一种用氢气作为能源的电池.这种燃料电池的效率要比传统内燃机的效率高很多,所以燃料电池汽车(FCV)会有很高的效率.Schlesinger等人提出可用NaBH4与水反应制氢气:BH4-+2H2O=BO2-+4H2↑(反应实质为水电离出来的H+被还原).该反应的生成H2的速率受外界条件影响.下表为pH和温度对NaBH4 半衰期的影响(半衰期是指反应过程中,某物质的浓度降低到初始浓度一半时所需的时间).
①已知,NaBH4与水反应后所得溶液显碱性,用离子方程式表示出溶液显碱性的原因 ,所以则溶液中各离子浓度大小关系为 .
②从上表可知,温度对NaBH4与水反应速率产生怎样的影响?答: .
③反应体系的pH为何会对NaBH4与水反应的反应速率产生影响?答: .
④实验表明,将NaBH4溶于足量水,释放的H2比理论产量少得多(即反应一段时间后有NaBH4剩余也不再反应).其可能原因是 .
(1)某甲醚燃料电池结构如图1,写出该电池工作时负极的电极反应式

(2)氢氧燃料电池是一种用氢气作为能源的电池.这种燃料电池的效率要比传统内燃机的效率高很多,所以燃料电池汽车(FCV)会有很高的效率.Schlesinger等人提出可用NaBH4与水反应制氢气:BH4-+2H2O=BO2-+4H2↑(反应实质为水电离出来的H+被还原).该反应的生成H2的速率受外界条件影响.下表为pH和温度对NaBH4 半衰期的影响(半衰期是指反应过程中,某物质的浓度降低到初始浓度一半时所需的时间).
| 体系pH | 不同温度下NaBH4的半衰期(min) | |||
| 0℃ | 25℃ | 50℃ | 75℃ | |
| 8 | 4.32×100 | 6.19×10-1 | 8.64×10-2 | 1.22×10-2 |
| 10 | 4.32×102 | 6.19×101 | 8.64×100 | 1.22×100 |
| 12 | 4.32×104 | 6.19×103 | 8.64×102 | 1.22×102 |
| 14 | 4.32×106 | 6.19×105 | 8.64×104 | 1.22×104 |
②从上表可知,温度对NaBH4与水反应速率产生怎样的影响?答:
③反应体系的pH为何会对NaBH4与水反应的反应速率产生影响?答:
④实验表明,将NaBH4溶于足量水,释放的H2比理论产量少得多(即反应一段时间后有NaBH4剩余也不再反应).其可能原因是
考点:化学电源新型电池,影响盐类水解程度的主要因素,盐类水解的应用
专题:
分析:(1)燃料电池的负极上是燃料失电子的氧化反应,正极上是氧气得电子的还原反应;
(2)①依据NaBH4与水反应制氢气:BH4-+2H2O=BO2-+4H2↑,反应生成的盐溶液BO2-在溶液中水解显碱性分析判断溶液中离子浓度大小;
②依据图表数据分析,随温度升高体系半衰期缩短,反应速率加快;
③分析图表数据可知PH增大,半衰期增长,反应速率减慢;
④随反应进行,溶液的pH逐渐增大,反应速率变小.常温时,当体系pH>12,半衰期为6.19×103min分析反应速率变慢判断.
(2)①依据NaBH4与水反应制氢气:BH4-+2H2O=BO2-+4H2↑,反应生成的盐溶液BO2-在溶液中水解显碱性分析判断溶液中离子浓度大小;
②依据图表数据分析,随温度升高体系半衰期缩短,反应速率加快;
③分析图表数据可知PH增大,半衰期增长,反应速率减慢;
④随反应进行,溶液的pH逐渐增大,反应速率变小.常温时,当体系pH>12,半衰期为6.19×103min分析反应速率变慢判断.
解答:
(1)甲醚燃料电池的负极上是燃料失电子的氧化反应,即CH3OCH3+3H2O-12e-=2CO2+12H+,融碳酸盐燃料电池中,CO、H2、O2在负极上失电子,正极上是氧气得电子的还原反应,即O2+4e-+2CO2=2CO32-;故答案为:CH3OCH3+3H2O-12e-=2CO2+12H+;CO、H2、O2;O2+4e-+2CO2=2CO32-;
(2)①NaBH4与水反应制氢气:BH4-+2H2O=BO2-+4H2↑,反应生成的盐溶液BO2-在溶液中水解显碱性,BO2-+2H2O?H3BO3+OH-,溶液中离子浓度大小为c(Na+)>c(BO2-)>c(OH-)>c(H+),
故答案为:BO2-+2H2O?H3BO3+OH-;c(Na+)>c(BO2-)>c(OH-)>c(H+);
②图表数据分析,随温度升高体系半衰期缩短,反应速率加快,故答案为:温度越大,反应速率越大;
③NaBH4与水反应制氢气:BH4-+2H2O=BO2-+4H2↑,反应实质为水电离出来的H+被还原,图表数据可知PH增大,半衰期增长,反应速率减慢,体系碱性越强,水电离出来的H+浓度越低,因而反应速率越慢,
故答案为:体系碱性越强,水电离出来的H+浓度越低,因而反应速率越慢;
④随反应进行,溶液的pH逐渐增大,反应速率变小.常温时,当体系pH>12,半衰期为6. 19×103min,反应速率很小,反应几乎停止,
故答案为:随着反应的进行,溶液的pH逐渐增大,反应速率变小.常温时,当体系pH>12,半衰期为6.19×103min(约为4.3天),反应速率很小,反应几乎停止.
(2)①NaBH4与水反应制氢气:BH4-+2H2O=BO2-+4H2↑,反应生成的盐溶液BO2-在溶液中水解显碱性,BO2-+2H2O?H3BO3+OH-,溶液中离子浓度大小为c(Na+)>c(BO2-)>c(OH-)>c(H+),
故答案为:BO2-+2H2O?H3BO3+OH-;c(Na+)>c(BO2-)>c(OH-)>c(H+);
②图表数据分析,随温度升高体系半衰期缩短,反应速率加快,故答案为:温度越大,反应速率越大;
③NaBH4与水反应制氢气:BH4-+2H2O=BO2-+4H2↑,反应实质为水电离出来的H+被还原,图表数据可知PH增大,半衰期增长,反应速率减慢,体系碱性越强,水电离出来的H+浓度越低,因而反应速率越慢,
故答案为:体系碱性越强,水电离出来的H+浓度越低,因而反应速率越慢;
④随反应进行,溶液的pH逐渐增大,反应速率变小.常温时,当体系pH>12,半衰期为6. 19×103min,反应速率很小,反应几乎停止,
故答案为:随着反应的进行,溶液的pH逐渐增大,反应速率变小.常温时,当体系pH>12,半衰期为6.19×103min(约为4.3天),反应速率很小,反应几乎停止.
点评:本题考查了溶液碱性的原因和图表数据分析总结规律和分析应用判断,题干信息的应用和分析判断是解题关键,题目难度中等.

练习册系列答案
 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案
相关题目
设NA代表阿伏加德罗常数的数值,下列说法中正确的是( )
| A、1.8 g重水(D2O)中含有的质子数和电子数均为NA |
| B、常温下,16gO2和O3的混合气体中含有的氧原子数为NA |
| C、标准状况下,22.4 L NO 和22.4 L O2混合后所得气体中分子总数为1.5 NA |
| D、将11.2 L Cl2通入足量的石灰乳中制备漂白粉,转移的电子数为0.5 NA |
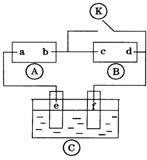 如图
如图 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现 上的c点显红色.为实现铁上镀铜,接通
上的c点显红色.为实现铁上镀铜,接通 后,使c、d两点短路.下列叙述正确的是( )
后,使c、d两点短路.下列叙述正确的是( )| A、a为直流电源的负极 |
| B、d极发生的反应为2H++2e-=H2↑ |
| C、f电极为铜板 |
| D、e极发生的反应为Cu-2e-=Cu2+ |
下列反应不属于氧化还原反应的是( )
| A、木炭与浓硫酸反应 |
| B、盐酸与氧化钙反应 |
| C、铜与稀硝酸反应 |
| D、铁粉与水蒸气反应 |
下列说法正确的是( )
| A、胶体区别于其他分散系的本质特征是有丁达尔效应 |
| B、SO3溶于水后所得溶液能导电,所以SO3是电解质 |
| C、NO2能与NaOH溶液反应,所以NO2是酸性氧化物 |
| D、SO2和Cl2都能使品红溶液褪色,但它们的漂白原理不同 |
下列判断中,正确的是( )
A、Na2CO3溶液中各离子浓度大小关系一定有c(Na+)>c(
| ||
| B、25℃时,Mg(OH)2固体在蒸馏水、盐酸和氯化铵溶液中的Kxp大小顺序为盐酸>氯化铵>蒸馏水 | ||
| C、已知25℃时NH4F显酸性,则25℃时的电离常数K(NH3?H2O)<K(HF) | ||
| D、AlCl3溶液和Al2(SO4)3溶液加热蒸干、灼烧都得到Al2O3 |