题目内容
已知2SO2(g)+O2(g)?2SO3(g)△H=-a kJ?mol-1(a>0).恒温恒容下,在10L的密闭容器中加入0.1mol SO2和0.05mol O2,经过2min达到平衡状态,反应放出热量x kJ下列判断正确的是( )
| A、反应放出热量x=0.05a |
| B、反应达到平衡状态时,2v(SO2)消耗=v(O2)生成 |
| C、若恒温恒压下,在10L的密闭容器中加入0.1mol SO2和0.05mol O2,平衡后反应放出的热量y kJ,则y<x |
| D、升高温度,平衡常数变小 |
考点:化学平衡的计算
专题:化学平衡专题
分析:A、2min达到平衡状态,反应放热xkJ,故参加反应的二氧化硫的物质的量为:2mol×
=
mol;
B、反应速率之比等于化学方程式计量数之比,为正反应速率之比;
C、恒压容器中,为保持恒压,体积减小,压强增大,平衡正向进行;
D、反应是放热反应,升温,平衡逆向进行,平衡常数减小;
| x |
| a |
| 2x |
| a |
B、反应速率之比等于化学方程式计量数之比,为正反应速率之比;
C、恒压容器中,为保持恒压,体积减小,压强增大,平衡正向进行;
D、反应是放热反应,升温,平衡逆向进行,平衡常数减小;
解答:
解:A.2min达到平衡状态,反应放热xkJ,故参加反应的二氧化硫的物质的量为:2mol×
=
mol,转化率不知,不能计算x和a的关系,故A错误;
B.v(SO2)消耗=2v(O2)生成,氧气正逆反应速率相同,反应达到平衡状态,但2v(SO2)消耗=v(O2)生成不能说明反应达到平衡状态,故B错误;
C.若恒温恒压下,在10L的密闭容器中加入0.1molSO2和0.05molO2,所到达的平衡,相当于在在原平衡基础上增大压强,平衡向正反应移动,反应物的转化率较原平衡大,则平衡后反应放热大于xkJ,y>x,故C错误;
D、2SO2(g)+O2(g)?2SO3(g)△H=-a kJ?mol-1(a>0),反应是放热反应,升温平衡逆向进行,平衡常数减小,故D正确;
故选D.
| x |
| a |
| 2x |
| a |
B.v(SO2)消耗=2v(O2)生成,氧气正逆反应速率相同,反应达到平衡状态,但2v(SO2)消耗=v(O2)生成不能说明反应达到平衡状态,故B错误;
C.若恒温恒压下,在10L的密闭容器中加入0.1molSO2和0.05molO2,所到达的平衡,相当于在在原平衡基础上增大压强,平衡向正反应移动,反应物的转化率较原平衡大,则平衡后反应放热大于xkJ,y>x,故C错误;
D、2SO2(g)+O2(g)?2SO3(g)△H=-a kJ?mol-1(a>0),反应是放热反应,升温平衡逆向进行,平衡常数减小,故D正确;
故选D.
点评:本题考查化学反应速率的计算、反应热的有关计算、化学平衡的移动,难度中等,注意D选项构建平衡建立的途径进行比较.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
某温度下,将3mol A和2mol B充入一密闭容器中,发生下列反应:aA(气)+B(气)?C(气)+D(气),5分钟后达到平衡状态,已知一定温度下,各物质的平衡浓度符合下列关系:[A]a[B]=[C][D],若在温度不变的条件下,将上述容器的体积扩大为原来的10倍,发现A的转化率不发生变化,则B的转化率为( )
| A、60% | B、40% |
| C、24% | D、4% |
在铁和氧化铁混合物15g中,加入稀硫酸150mL,能发出H21.68L(标准状况).同时铁和氧化铁均无剩余,向反应后的溶液中滴入KSCN溶液,未见颜色变化.为了中和过量的H2SO4,且使Fe2+完全转化成Fe(OH)2,共消耗3mol?L-1的NaOH溶液200mL,则硫酸的物质的量浓度是( )
| A、1.5mol?L-1 |
| B、2mol?L-1 |
| C、2.5mol?L-1 |
| D、3mol?L-1 |
某金属硝酸盐加热分解生成的NO2和O2的物质的量之比是3:1,则在加热过程中,该金属元素的化合价( )
| A、降低 | B、升高 |
| C、不变 | D、无法确定 |
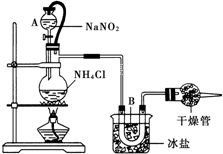 实验室常用饱和NaNO2与NH4Cl溶液反应制取纯净氮气,如图.反应式为:NaNO2+NH4Cl═NaCl+N2↑+2H2O;反应放热.试回答:
实验室常用饱和NaNO2与NH4Cl溶液反应制取纯净氮气,如图.反应式为:NaNO2+NH4Cl═NaCl+N2↑+2H2O;反应放热.试回答: