题目内容
0.01mol/LHCl溶液pH为 ,0.005mol/LBa(OH)2溶液pH为 .
考点:pH的简单计算
专题:电离平衡与溶液的pH专题
分析:在25℃时,在0.01mol/L HCl溶液中,c(H+)=c(HCl)=0.01mol/L,根据pH=-lgc(H+)计算即可;
碱溶液中先计算氢氧根离子浓度,再根据氢离子浓度与氢氧根离子浓度和离子积常数之间的关系式计算.
碱溶液中先计算氢氧根离子浓度,再根据氢离子浓度与氢氧根离子浓度和离子积常数之间的关系式计算.
解答:
解:在25℃时,在0.01mol/L HCl溶液中,c(H+)=c(HCl)=0.01mol/L,pH=-lgc(H+)=-lg0.01mol/L=2;
0.05mol/LBa(OH)2溶液中氢氧根离子浓度=0.005 mol/L×2=0.01mol/L,根据离子积常数KW=c(H+)?c(OH-),知,溶液中氢离子浓度c(H+)=
mol/L=10-12mol/L,所以溶液的pH=12,
故答案为:2;12.
0.05mol/LBa(OH)2溶液中氢氧根离子浓度=0.005 mol/L×2=0.01mol/L,根据离子积常数KW=c(H+)?c(OH-),知,溶液中氢离子浓度c(H+)=
| 10-14 |
| 0.01 |
故答案为:2;12.
点评:本题考查了pH的有关计算,明确氢离子浓度、氢氧根离子浓度和离子积常数之间的关系是解本题关键,题目难度不大.

练习册系列答案
相关题目
汽车上的催化转化器可将尾气中的主要污染物转化成无毒物质,反应为:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-a kJ/mol(a>0)
在某温度时,用气体传感器测得不同时间的NO和CO浓度如下表:
经分析,得出结论不正确的是( )
在某温度时,用气体传感器测得不同时间的NO和CO浓度如下表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/10-4mol?L-1 | 10.0 | 4.05 | 2.50 | 1.60 | 1.00 | 1.00 |
| c(CO)/10-3mol?L-1 | 3.60 | 3.05 | 2.85 | 2.76 | 2.70 | 2.70 |
| A、2~3s间的平均反应速率v(NO)=9×10-5mol/(L?s) |
| B、催化转化器对废气的转化速率在夏季时比冬季时高 |
| C、若该催化转化器气舱容积为2L,则达到平衡时反应放出热量1.8a J |
| D、该温度下,此反应的平衡常数K=5000 |
已知2SO2(g)+O2(g)?2SO3(g)△H=-a kJ?mol-1(a>0).恒温恒容下,在10L的密闭容器中加入0.1mol SO2和0.05mol O2,经过2min达到平衡状态,反应放出热量x kJ下列判断正确的是( )
| A、反应放出热量x=0.05a |
| B、反应达到平衡状态时,2v(SO2)消耗=v(O2)生成 |
| C、若恒温恒压下,在10L的密闭容器中加入0.1mol SO2和0.05mol O2,平衡后反应放出的热量y kJ,则y<x |
| D、升高温度,平衡常数变小 |
一定温度下将1mol CO和1mol水蒸气在密闭容器中反应:CO(g)+H2O(g)?CO(g)2+H2(g),平衡后测得CO2为0.6mol,再通入4mol水蒸气,达新平衡后CO2的物质的量可能是( )
| A、0.6mol |
| B、1mol |
| C、0.8mol |
| D、1.2mol |
 如图所示的电解池I和II中,a、b、c和d均为Pt电极.电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b>d.符合上述实验结果的盐溶液是( )
如图所示的电解池I和II中,a、b、c和d均为Pt电极.电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b>d.符合上述实验结果的盐溶液是( )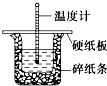 50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1 NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中的热量可计算中和热.回答下列问题:
50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1 NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中的热量可计算中和热.回答下列问题: