题目内容
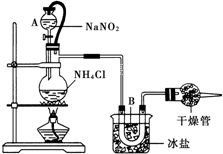 实验室常用饱和NaNO2与NH4Cl溶液反应制取纯净氮气,如图.反应式为:NaNO2+NH4Cl═NaCl+N2↑+2H2O;反应放热.试回答:
实验室常用饱和NaNO2与NH4Cl溶液反应制取纯净氮气,如图.反应式为:NaNO2+NH4Cl═NaCl+N2↑+2H2O;反应放热.试回答:(1)装置中A部分的分液漏斗与蒸馏烧瓶之间连接的导管所起的作用是
A.防止NaNO2饱和溶液蒸发
B.保证实验装置不漏气
C.使NaNO2饱和溶液容易滴下
(2)B部分的作用是
①冷凝 ②冷却氮气 ③缓冲氮气流
(3)加热前必须进行的一个操作步骤是
加热片刻后,应立即移去酒精灯以防反应物冲出,其原因是
(4)收集N2前,必须进行的步骤是(用文字说明)
①用排气法收集在集气瓶中;②用排水法收集在集气瓶中;③直接收集在球胆或塑料袋中.
考点:常见气体制备原理及装置选择
专题:实验题
分析:(1)分液漏斗与蒸馏烧瓶之间连接的导管,可使烧瓶内压强与分液漏斗压强相等;
(2)B中装有冰盐,可起到冷凝的作用;
(3)制备气体,在实验前一定要检验气密性,该反应为放热反应;
(4)收集N2前,必需将系统内空气排净,氮气密度可空气相接近,不能用排空法收集,收集纯净的氮气,可用球胆或塑料袋直接收集.
(2)B中装有冰盐,可起到冷凝的作用;
(3)制备气体,在实验前一定要检验气密性,该反应为放热反应;
(4)收集N2前,必需将系统内空气排净,氮气密度可空气相接近,不能用排空法收集,收集纯净的氮气,可用球胆或塑料袋直接收集.
解答:
解:(1)分液漏斗与蒸馏烧瓶之间连接的导管,可使烧瓶内压强与分液漏斗压强相等,使饱和NaNO2溶液容易滴下,
故答案为:C;
(2)B中装有冰盐,可起到冷凝的作用,
故答案为:①;
(3)制备气体,在实验前一定要检验气密性,该反应为放热反应,加热片刻后,应立即移去酒精灯,以防温度过高反应物冲出,
故答案为:检查装置的气密性;本反应为放热反应;
(4)氮气密度可空气相接近,不能用排空法收集,收集纯净的氮气,可用球胆或塑料袋直接收集,而用排水法不能得到纯净氮气,
故答案为:将系统内空气排净;①.
故答案为:C;
(2)B中装有冰盐,可起到冷凝的作用,
故答案为:①;
(3)制备气体,在实验前一定要检验气密性,该反应为放热反应,加热片刻后,应立即移去酒精灯,以防温度过高反应物冲出,
故答案为:检查装置的气密性;本反应为放热反应;
(4)氮气密度可空气相接近,不能用排空法收集,收集纯净的氮气,可用球胆或塑料袋直接收集,而用排水法不能得到纯净氮气,
故答案为:将系统内空气排净;①.
点评:本题考查较为综合,侧重于气体制备方案的设计,注意把握反应原理以及实验方法的设计,题目难度不大,但信息量较大,答题时注意审题.

练习册系列答案
相关题目
在入住装修过的新房前,下列做法中错误的是( )
| A、装修新房季节最好选择夏季 |
| B、适度开窗通风,充分地进行内外空气对流 |
| C、用高浓度的甲醛对室内环境消毒 |
| D、在各个房间内均匀的放置适量的吊兰、芦荟等鲜花 |
某温度下,C和H2O(g)在密闭容器里发生下列反应:
C(s)+H2O(g)?CO(g)+H2(g);
CO(g)+H2O(g)?CO2(g)+H2(g).
当反应达到平衡时,c(H2)=1.9mol?L-1,c(CO)=0.1mol?L-1.则下列叙述正确的有( )
C(s)+H2O(g)?CO(g)+H2(g);
CO(g)+H2O(g)?CO2(g)+H2(g).
当反应达到平衡时,c(H2)=1.9mol?L-1,c(CO)=0.1mol?L-1.则下列叙述正确的有( )
| A、CO在平衡时转化率为10% |
| B、平衡浓度c(CO2)=c(H2) |
| C、平衡时气体平均相对分子质量约为23.3 |
| D、其他条件不变时,缩小体积,H2O(g)的转化率随之降低 |
已知2SO2(g)+O2(g)?2SO3(g)△H=-a kJ?mol-1(a>0).恒温恒容下,在10L的密闭容器中加入0.1mol SO2和0.05mol O2,经过2min达到平衡状态,反应放出热量x kJ下列判断正确的是( )
| A、反应放出热量x=0.05a |
| B、反应达到平衡状态时,2v(SO2)消耗=v(O2)生成 |
| C、若恒温恒压下,在10L的密闭容器中加入0.1mol SO2和0.05mol O2,平衡后反应放出的热量y kJ,则y<x |
| D、升高温度,平衡常数变小 |
实验要快速制取H2,最好的方法是( )
| A、纯锌和稀H2SO4反应 |
| B、纯锌和浓硫酸反应 |
| C、粗锌和浓H2SO4反应 |
| D、粗锌和稀硫酸反应 |
将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),使其达到分解平衡:NH2COONH4(s)?2NH3(g)+CO2(g).实验测得不同温度下的平衡数据列于下表:( )
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/10-3mol/L | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
| A、该可逆反应达到平衡的标志之一是混合气体平均相对分子质量不变 |
| B、因该反应熵变(△S)大于0,焓变(△H)大于0,所以在低温下自发进行 |
| C、根据表中数据,计算15.0℃时的分解平衡常数约为2.0×10-9(mol?L-1)3 |
| D、达到平衡后,若在恒温下压缩容器体积,氨基甲酸铵固体的质量减小 |
