题目内容
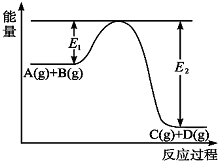 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题.(1)该反应是
(2)当反应达到平衡时,升高温度,A的转化率
(3)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1
考点:反应热和焓变,化学平衡的影响因素
专题:化学平衡专题
分析:(1)分析图象中物质能量变化可知AB反应物能量高于生成物CD,反应是放热反应;
(2)反应前后气体体积不变,增大压强平衡不动,A的转化率不变;
(3)催化剂能同等程度地改变正逆反应速率,减小反应的活化能.
(2)反应前后气体体积不变,增大压强平衡不动,A的转化率不变;
(3)催化剂能同等程度地改变正逆反应速率,减小反应的活化能.
解答:
解:(1)分析图象中物质能量变化可知AB反应物能量高于生成物CD,反应是放热反应,A(g)+B(g)?C(g)+D(g)过程中的能量变化为放热,
故答案为:放热;
(2)A(g)+B(g)?C(g)+D(g)反应为放热反应,升高温度平衡逆向移动,A的转化率减小,
故答案为:减小;升温,平衡逆向移动;
(3)其它条件不变在反应体系中加入催化剂,能同等程度地改变正逆反应速率,降低了反应的活化能,反应物和生成物的活化能都会降低,
故答案为:E1减小,E2减小.
故答案为:放热;
(2)A(g)+B(g)?C(g)+D(g)反应为放热反应,升高温度平衡逆向移动,A的转化率减小,
故答案为:减小;升温,平衡逆向移动;
(3)其它条件不变在反应体系中加入催化剂,能同等程度地改变正逆反应速率,降低了反应的活化能,反应物和生成物的活化能都会降低,
故答案为:E1减小,E2减小.
点评:本题考查了化学反应能量变化的分析判断,影响化学平衡的因素分析,注意催化剂改变反应速率不改变化学平衡,题目较简单.答题:

练习册系列答案
相关题目
下列离子中,不可能与H+大量共存于同一溶液中的是( )
A、S
| ||
| B、Cl- | ||
| C、Cu2+ | ||
D、N
|
密闭容器中的可逆反应 2HI(g)?I2(g)+H2(g),能说明反应达到平衡的是( )
| A、容器内压强不变 |
| B、单位时间内消耗2molHI,同时生成1molH2 |
| C、HI的浓度与I2的浓度相等 |
| D、混合气体的颜色不变 |
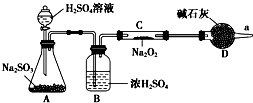 ①某学生根据SO2具有还原性判断SO2和Na2O2反应能生成硫酸钠,该同学无法断定反应中是否有氧气生成,拟使用如图所示装置进行实验(A为SO2的发生装置,图中铁架台等装置已略去).
①某学生根据SO2具有还原性判断SO2和Na2O2反应能生成硫酸钠,该同学无法断定反应中是否有氧气生成,拟使用如图所示装置进行实验(A为SO2的发生装置,图中铁架台等装置已略去).