题目内容
(1)用双线桥法表示下列氧化还原反应,并指出氧化剂和还原剂.
Zn+H2SO4(稀)
Zn SO4+H2↑ 氧化剂 还原剂
MnO2+4H Cl(浓)
MnCl2+Cl2↑+2H2 O氧化剂 还原剂
(2)用单线桥法表示下列氧化还原反应,并指出氧化剂和还原剂.
Fe2O3+3CO
Fe+3CO2 氧化剂 还原剂 .
Zn+H2SO4(稀)
| ||
MnO2+4H Cl(浓)
| ||
(2)用单线桥法表示下列氧化还原反应,并指出氧化剂和还原剂.
Fe2O3+3CO
| ||
考点:氧化还原反应
专题:氧化还原反应专题
分析:(1)在反应Zn+H2SO4═ZnSO4+H2↑中,Zn元素的化合价由0升高到+2价,则Zn为还原剂,H元素的化合价由+1降低到0价,则H2SO4为氧化剂,
反应MnO2+4H Cl(浓)
MnCl2+Cl2↑+2H2O中,化合价升高元素是Cl,所在反应物HCl是还原剂,化合价降低的是Mn元素,所在反应物MnO2是氧化剂,结合化合价的变化判断;
(2)Fe2O3+3CO
Fe+3CO2中,Fe元素的化合价由+3价降低为0,C元素的化合价由+2价升高为+4价,以此来解答.
反应MnO2+4H Cl(浓)
| ||
(2)Fe2O3+3CO
| ||
解答:
解:(1)在反应Zn+H2SO4═ZnSO4+H2↑中,Zn元素的化合价由0升高到+2价,则Zn为还原剂,H元素的化合价由+1降低到0价,则H2SO4为氧化剂,
该反应中转移的电子数为2e-,电子转移的方向和数目为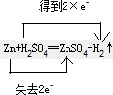 ,反应MnO2+4H Cl(浓)
,反应MnO2+4H Cl(浓)
MnCl2+Cl2↑+2H2O中,化合价升高元素是Cl,所在反应物HCl是还原剂,化合价降低的是Mn元素,所在反应物MnO2是氧化剂,化合价升高的Cl元素失2mol电子,化合价降低的Mn元素得到2mol电子,电子转移情况为: ,
,
故答案为: ;H2SO4;Zn;
;H2SO4;Zn; ;MnO2;HCl;
;MnO2;HCl;
(2)Fe元素的化合价由+3价降低为0,C元素的化合价由+2价升高为+4价,反应Fe2O3为氧化剂,为还原剂,则电子转移的方向和数目为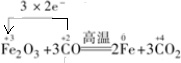 ,
,
故答案为: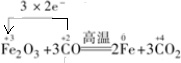 ;Fe2O3;CO.
;Fe2O3;CO.
该反应中转移的电子数为2e-,电子转移的方向和数目为
 ,反应MnO2+4H Cl(浓)
,反应MnO2+4H Cl(浓)
| ||
 ,
,故答案为:
 ;H2SO4;Zn;
;H2SO4;Zn; ;MnO2;HCl;
;MnO2;HCl;(2)Fe元素的化合价由+3价降低为0,C元素的化合价由+2价升高为+4价,反应Fe2O3为氧化剂,为还原剂,则电子转移的方向和数目为
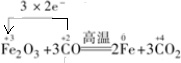 ,
,故答案为:
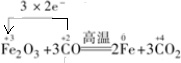 ;Fe2O3;CO.
;Fe2O3;CO.
点评:本题考查氧化还原反应,为高考常见题型,把握反应中元素的化合价变化为解答的关键,侧重基本概念和转移电子的考查,题目难度不大.

练习册系列答案
相关题目
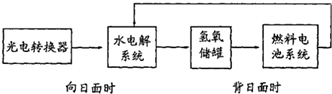 右图是某太空空间站能量转化系统的局部示意图,基中燃料电池采用KOH为电解液,下列有关说法中正确的是( )
右图是某太空空间站能量转化系统的局部示意图,基中燃料电池采用KOH为电解液,下列有关说法中正确的是( )| A、该能量转化系统工作时,需不断补充H2O |
| B、该转化系统的能量本质上来源于太阳能 |
| C、水电解系统中的阴极反应:4OH--4e-=O2+2H2O |
| D、燃料电池放电时的负极反应:H2-2e-=2H+ |
根据所学知识,下列离子在溶液中易与SCN-结合的是( )
| A、K+ | ||
B、NH
| ||
| C、Na+ | ||
| D、Fe3+ |
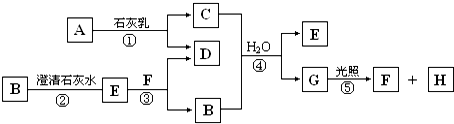
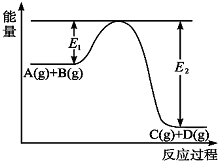 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题. 根据反应:mA(g)+nB(g)?pC(g)△H,结合图中所给的信息填空.
根据反应:mA(g)+nB(g)?pC(g)△H,结合图中所给的信息填空.