题目内容
11.下列关于杂化轨道的叙述中,不正确的是( )| A. | 分子中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构 | |
| B. | 杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对 | |
| C. | 若AB2分子的构型为V型,则A可能为sp2杂化 | |
| D. | H2S和SO2分子中的中心原子杂化类型相同 |
分析 A.价层电子对个数为4,不含孤电子对,为正四面体结构;含有一个孤电子对,空间构型为三角锥形,含有两个孤电子对,空间构型是V型;
B.杂化轨道只用于形成σ键或用于容纳未参与成键的孤对电子;
C.采用sp2杂化,含有3个σ键,或含有2个σ键和1个孤电子对;
D.根据价层电子对互斥理论确定分子中原子杂化方式.
解答 解:A.分子的立体构型是指分子中的原子在空间的排布,不包括中心原子未成键的孤对电子;实际空间构型要去掉孤电子对,中心原子采取sp3杂化的分子,其立体构形不一定是正四面体,如水分子中价层电子对个数=2+$\frac{1}{2}$×(6-2×1)=4,VSEPR模型为正四面体结构;含有2个孤电子对,略去孤电子对后,实际上其空间构型是V型,故A正确;
B.杂化轨道只用于形成σ键或用于容纳未参与成键的孤对电子,没有杂化的P轨道形成π键,故B正确;
C.二氧化硫分子中价层电子对=2+1=3,含有2个σ键和1个孤电子对,采用sp2杂化,分子构型为V形,所以A原子可能是sp2杂化,故C正确;
D.H2S分子中S原子价层电子对个数是4且含有2个孤电子对,所以S原子采用sp3杂化,二氧化硫分子中价层电子对=2+1=3,含有2个σ键和1个孤电子对,采用sp2杂化,故D错误;
故选D.
点评 本题考查杂化轨道和杂化理解,侧重分子结构与性质的考查,注意杂化轨道理论的理解应用,把握常见分子中原子的杂化及空间构型为解答的关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.下列说法正确的是( )
| A. | 100℃时,0.001mol•L-1的NaOH溶液pH=11 | |
| B. | 若溶液中c(H+)与c(OH-)相等,溶液肯定呈中性 | |
| C. | 25℃,0.001mol/LH2SO4溶液中,水电离出的c(OH-)为10-11mol/L | |
| D. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
19.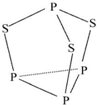 三硫化四磷用于制造火柴及火柴盒摩擦面,分子结构如图所示.下列有关三硫化四磷的说法中正确的是( )
三硫化四磷用于制造火柴及火柴盒摩擦面,分子结构如图所示.下列有关三硫化四磷的说法中正确的是( )
 三硫化四磷用于制造火柴及火柴盒摩擦面,分子结构如图所示.下列有关三硫化四磷的说法中正确的是( )
三硫化四磷用于制造火柴及火柴盒摩擦面,分子结构如图所示.下列有关三硫化四磷的说法中正确的是( )| A. | 该物质中磷元素的化合价为+3 | |
| B. | 该物质分子中不含非极性共价键 | |
| C. | 该物质的熔、沸点比P4低 | |
| D. | 该物质22 g含硫原子的数目约为1.806×1023 |
6.下列物质:①BeCl2 ②C2H4 ③P4 ④BF3 ⑤NF3 ⑥H2O2,其中含极性键的非极性分子是( )
| A. | ①③④ | B. | ②③⑥ | C. | ①②④ | D. | ③④⑤ |
16.根据下表中五种元素的电离能数据(单位:kJ•mol-1),下列说法不正确的是( )
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| u | 420 | 3100 | 4400 | 5900 |
| A. | T的氯化物最可能的化学式为TCl3 | |
| B. | 氦元素最有可能与Q元素位于同一族 | |
| C. | 在同周期表中,最可能处于同一族的是R和U | |
| D. | U元素最有可能为K,R元素最有可能为Li |
20.在我们的日常生活中出现了“加碘食盐”“高钙牛奶”“含氟牙膏”等商品.这里的碘、钙、氟指的是( )
| A. | 元素 | B. | 单质 | C. | 分子 | D. | 原子 |
1.下列颜色变化与氧化还原反应无关的是( )
| A. | 长期放置的苯酚晶体变红 | B. | 硝酸银晶体光照后变黑 | ||
| C. | 氢氧化亚铁变灰绿再变红褐 | D. | 二氧化碳气体冷却后变淡 |
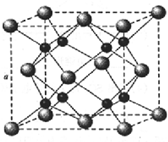 A、B、C、D为原子序数依次增大的四种元素,A原子基态时原子轨道上有两个未成对电子,A2-和B+具有相同的电子层结构;C、D为同周期元素,C元素基态原子核外电子总数是其最外层电子数的3倍;D元素基态原子的最包层有一个未成对电子.回答下列问题:
A、B、C、D为原子序数依次增大的四种元素,A原子基态时原子轨道上有两个未成对电子,A2-和B+具有相同的电子层结构;C、D为同周期元素,C元素基态原子核外电子总数是其最外层电子数的3倍;D元素基态原子的最包层有一个未成对电子.回答下列问题: