题目内容
1.下列说法正确的是( )| A. | 100℃时,0.001mol•L-1的NaOH溶液pH=11 | |
| B. | 若溶液中c(H+)与c(OH-)相等,溶液肯定呈中性 | |
| C. | 25℃,0.001mol/LH2SO4溶液中,水电离出的c(OH-)为10-11mol/L | |
| D. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
分析 A.先计算c(OH-),根据Kw=c(H+)•c(OH-)=1×10-12,计算溶液中c(H+),再利用pH=-lgc(H+)计算;
B.如果溶液中c(H+)=c(OH-),则溶液肯定呈中性;
C.根据Kw=c(H+)•c(OH-)=1×10-14,计算溶液中c(OH-),溶液中的OH-全部来自水的电离;
D.CH3COONH4为弱酸弱碱盐,促进水的电离.
解答 解:A.0.001mol•L-1NaOH溶液的c(OH-)=c(NaOH)=1×10-3mol/L,100℃时,Kw=c(H+)•c(OH-)=1×10-12,c(H+)=$\frac{1{0}^{-12}}{1{0}^{-3}}$=10-9mol/L,pH=-lgc(H+)=9,故A错误;
B.如果溶液中c(H+)=c(OH-),则溶液肯定呈中性,c(H+)>c(OH-)时溶液呈酸性,c(H+)<c(OH-)时溶液呈碱性,故B正确;
C.25℃,0.001mol/LH2SO4溶液中,c(H+)=2c(H2SO4)=0.002mol/L,水电离出的c(OH-)=$\frac{1{0}^{-14}}{0.002}$=5×10-12mol/L,故C错误;
D.CH3COONH4促进水的电离,NaCl对水的电离无影响,所以两溶液中水的电离程度不同,故D错误;
故选B.
点评 本题考查PH计算、溶液酸碱性、盐类水解、水的电离等知识点,综合性较强,溶液酸碱性要根据c(H+)、c(OH-)相对大小判断,不能根据溶液pH大小判断,易错选项是D,弱酸弱碱盐,促进水的电离,题目难度中等.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
12. 某化学实验小组用0.2000 mol/L的酸性KMnO4溶液测定草酸晶体的纯度(草酸晶体化学式为H2C2O4•2H2O,杂质不与KMnO4反应).实验步骤如下:
某化学实验小组用0.2000 mol/L的酸性KMnO4溶液测定草酸晶体的纯度(草酸晶体化学式为H2C2O4•2H2O,杂质不与KMnO4反应).实验步骤如下:
(1)称取13.0 g草酸晶体,配成250.00 mL水溶液.此操作过程必须用到的2种定量仪器是托盘天平和250mL容量瓶.
(2)量取草酸溶液25.00 mL放入锥形瓶中,用0.2000 mol/L的酸性KMnO4溶液滴定.
①量取25.00 mL草酸溶液的仪器是25mL酸式滴定管(或25mL移液管).
②酸化KMnO4溶液的酸应为稀硫酸.(选填“盐酸”或“稀硫酸”或“稀硝酸”)
③配平离子方程式:□MnO→+□H2C2O4+□H+→□Mn2++□CO2↑+□H2O
④滴定达到终点的标志是加入最后一滴高锰酸钾溶液,锥形瓶内溶液由无色变为红色,且半分钟不褪色.
(3)按正确操作测得有关数据记录如下:
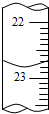
①a的读数如图所示,则a=22.80;
②草酸晶体的纯度为98.86%(结果保留两位小数).
(4)在上述实验中,下列操作(其它操作正确)一定会造成测定结果偏低的是C.
A.称取13.0 g草酸晶体时,将草酸晶体放在托盘天平右盘
B.锥形瓶水洗后未用草酸溶液润洗
C.读取KMnO4溶液体积时,开始仰视读数,滴定结束时俯视读数
D.盛KMnO4溶液的酸式滴定管尖嘴部分有气泡,滴定后气泡消失.
 某化学实验小组用0.2000 mol/L的酸性KMnO4溶液测定草酸晶体的纯度(草酸晶体化学式为H2C2O4•2H2O,杂质不与KMnO4反应).实验步骤如下:
某化学实验小组用0.2000 mol/L的酸性KMnO4溶液测定草酸晶体的纯度(草酸晶体化学式为H2C2O4•2H2O,杂质不与KMnO4反应).实验步骤如下:(1)称取13.0 g草酸晶体,配成250.00 mL水溶液.此操作过程必须用到的2种定量仪器是托盘天平和250mL容量瓶.
(2)量取草酸溶液25.00 mL放入锥形瓶中,用0.2000 mol/L的酸性KMnO4溶液滴定.
①量取25.00 mL草酸溶液的仪器是25mL酸式滴定管(或25mL移液管).
②酸化KMnO4溶液的酸应为稀硫酸.(选填“盐酸”或“稀硫酸”或“稀硝酸”)
③配平离子方程式:□MnO→+□H2C2O4+□H+→□Mn2++□CO2↑+□H2O
④滴定达到终点的标志是加入最后一滴高锰酸钾溶液,锥形瓶内溶液由无色变为红色,且半分钟不褪色.
(3)按正确操作测得有关数据记录如下:
| 滴定次数 | 草酸溶液体积 | 酸性KMnO4溶液体积 | |
| 滴定前读数/mL | 滴定后读数/mL | ||
| 第一次 | 25.00 | 0.20 | 20.58 |
| 第二次 | 25.00 | 4.00 | 24.40 |
| 第三次 | 25.00 | 2.38 | a |
②草酸晶体的纯度为98.86%(结果保留两位小数).
(4)在上述实验中,下列操作(其它操作正确)一定会造成测定结果偏低的是C.
A.称取13.0 g草酸晶体时,将草酸晶体放在托盘天平右盘
B.锥形瓶水洗后未用草酸溶液润洗
C.读取KMnO4溶液体积时,开始仰视读数,滴定结束时俯视读数
D.盛KMnO4溶液的酸式滴定管尖嘴部分有气泡,滴定后气泡消失.
6.下列有机化合物的同分异构体数目最多的是( )
| A. | 分子式为C5H10O2的酯类 | B. | 分子式为C5H10的烯烃 | ||
| C. | 分子式为C5H12O的醇类 | D. | 分子式为C5H12的所有化合物 |
11.下列关于杂化轨道的叙述中,不正确的是( )
| A. | 分子中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构 | |
| B. | 杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对 | |
| C. | 若AB2分子的构型为V型,则A可能为sp2杂化 | |
| D. | H2S和SO2分子中的中心原子杂化类型相同 |
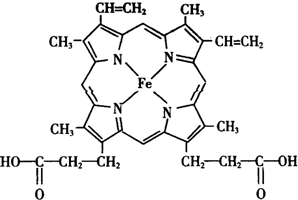 人类很早就懂得使用铁器,如今对铁元素的研究依然热度不减.请回答:
人类很早就懂得使用铁器,如今对铁元素的研究依然热度不减.请回答: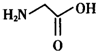 ),其分子中σ键和π键的个数比为9:1.
),其分子中σ键和π键的个数比为9:1.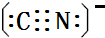 ,与其配体互为等电子体的微粒有N2、CO(任写两种,填化学式).
,与其配体互为等电子体的微粒有N2、CO(任写两种,填化学式).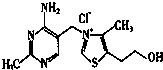 请回答下列问题:
请回答下列问题:
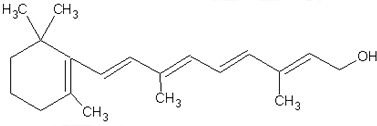
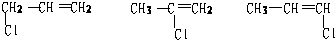 .
.