题目内容
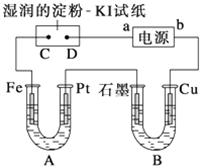 电解装置如图所示.图中B装置盛1L 2mol?L-1的Na2SO4溶液,A装置中盛1L 2mol?L-1AgNO3溶液.通电后,湿润的淀粉KI试纸的C端变蓝色.电解一段时间后,试回答:
电解装置如图所示.图中B装置盛1L 2mol?L-1的Na2SO4溶液,A装置中盛1L 2mol?L-1AgNO3溶液.通电后,湿润的淀粉KI试纸的C端变蓝色.电解一段时间后,试回答:(1)电源a极为
(2)Fe电解的电解反应式
(3)A装置中发生反应的化学方程式
(4)B装置中观察到的现象是
考点:电解原理
专题:电化学专题
分析:通电一段时间后,发现湿润的淀粉KI试纸的C端变为蓝色,则C端发生2I--2e-=I2,则C端为阳极,D为阴极,即a为电源的负极,b为电源的正极,结合离子的放电顺序及发生的电极反应来解答.
解答:
解:通电一段时间后,发现湿润的淀粉KI试纸的C端变为蓝色,则C端发生2I--2e-=I2,则C端为阳极,D为阴极,即a为电源的负极,b为电源的正极,
(1)a为电源的负极,故答案为:负;
(2)A中Fe连接电源的负极,则为电解池的阴极,发生还原反应,为电解池的阴极,电极方程式为Ag++e-=Ag,B中石墨为阴极,氢离子得电子生成氢气,电极方程式为2H++2e-=H2↑,
故答案为:Ag++e-=Ag;2H++2e-=H2↑;
(3)A为电解AgNO3溶液,阴极生成Ag,阳极生成氧气,方程式为4AgNO3+2H2O
4Ag+O2↑+4HNO3,故答案为:4AgNO3+2H2O
4Ag+O2↑+4HNO3;
(4)B中盛有饱和Na2SO4溶液,Cu为阳极,阳极生成铜离子,Cu极周围变蓝色,阴极生成氢气,溶液生成氢氧化铜沉淀,
故答案为:Cu棒周围开始时变蓝色,石墨上有气泡产生,一段时间后,U形管B的底部有沉淀.
(1)a为电源的负极,故答案为:负;
(2)A中Fe连接电源的负极,则为电解池的阴极,发生还原反应,为电解池的阴极,电极方程式为Ag++e-=Ag,B中石墨为阴极,氢离子得电子生成氢气,电极方程式为2H++2e-=H2↑,
故答案为:Ag++e-=Ag;2H++2e-=H2↑;
(3)A为电解AgNO3溶液,阴极生成Ag,阳极生成氧气,方程式为4AgNO3+2H2O
| ||
| ||
(4)B中盛有饱和Na2SO4溶液,Cu为阳极,阳极生成铜离子,Cu极周围变蓝色,阴极生成氢气,溶液生成氢氧化铜沉淀,
故答案为:Cu棒周围开始时变蓝色,石墨上有气泡产生,一段时间后,U形管B的底部有沉淀.
点评:本题综合考查电解原理,侧重于考查学生综合运用电解知识的能力,题目难度较大,注意把握电解规律,能正确判断电极方程式.

练习册系列答案
相关题目
下列各组金属混合物质量相同,它们分别跟足量盐酸反应,在相同状况下产生氢气的体积也相同,则其中锌的质量分数最高的是( )
| A、Zn和Al |
| B、Zn和Al |
| C、Zn和Mg |
| D、Zn和Na |
设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A、56g铁片投入足量浓H2SO4中生成NA个SO2分子 |
| B、1molNO2溶于水后溶液中含有NA个NO3- |
| C、常温常压下,44gCO2与22.4LSO2所含分子数相等 |
| D、0℃、1.015Pa时,11.2L氧气中所含的原子数为NA |
下列各组混合物中,都能用分液漏斗的是( )
| A、乙酸乙酯和水 酒精和水 苯酚和水 |
| B、二溴乙烷和水 溴苯和水 硝基苯和水 |
| C、甘油和水 己烷和水 甲酸和水 |
| D、苯和甲苯 乙醛和水 乙酸和乙醇 |
 将NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水.产生1.16g白色沉淀,再向所得溶液中逐渐加入1.00mol/L的盐酸,加入盐酸的体积和生成沉淀的关系如图所示:
将NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水.产生1.16g白色沉淀,再向所得溶液中逐渐加入1.00mol/L的盐酸,加入盐酸的体积和生成沉淀的关系如图所示: