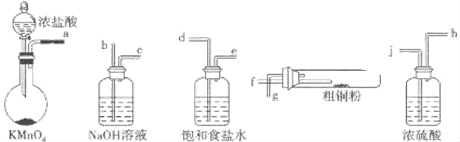
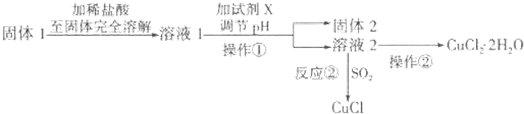
题目内容
11.如图1是某课题组设计的合成聚酯类高分子材料的路线: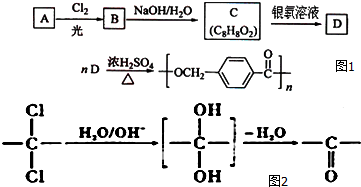
已知:①烃A的相对分子质量为106;
②同一碳原子上连两个羟基时结构不稳定,易脱水生成醛或酮(如图2)
③C可发生银镜反应. 请根据以上信息回答下列问题:
(1)A的名称对二甲苯.
(2)由A生成B的反应类型是取代反应;由C生成D的反应类型是氧化反应.
(3)由B生成C的化学方程式为
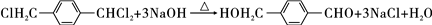 ,该反应过程中生成的不稳定中间体的结构简式应是
,该反应过程中生成的不稳定中间体的结构简式应是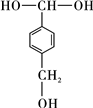 .
.(4)D的分子式为C8H8O3;D的同分异构体中,满足下列条件的有6种.
①仅含有苯环,无其他环状结构;
②遇三氯化铁溶液显紫色;
③1mol能与3mol金属钠反应生成1.5mol氢气.
其中核磁共振氢谱表明分子中有五种氢,且其峰面积之比为2:2:2:1:1,请写出其结构简式:
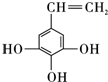 .
.
分析 合成聚酯类高分子材料  ,由D合成该物质发生缩聚反应,则D为
,由D合成该物质发生缩聚反应,则D为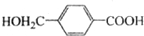 ,D由C氧化生成,则C为
,D由C氧化生成,则C为 ,由B发生水解反应生成C,A发生取代反应生成B,且烃A的相对分子质量为106,则A的结构简式为
,由B发生水解反应生成C,A发生取代反应生成B,且烃A的相对分子质量为106,则A的结构简式为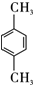 ,结合信息②可知,A→B发生三氯取代,即B为
,结合信息②可知,A→B发生三氯取代,即B为 .
.
解答 解:合成聚酯类高分子材料  ,由D合成该物质发生缩聚反应,则D为
,由D合成该物质发生缩聚反应,则D为 ,D由C氧化生成,则C为
,D由C氧化生成,则C为 ,由B发生水解反应生成C,A发生取代反应生成B,且烃A的相对分子质量为106,则A的结构简式为
,由B发生水解反应生成C,A发生取代反应生成B,且烃A的相对分子质量为106,则A的结构简式为 ,结合信息②可知,A→B发生三氯取代,即B为
,结合信息②可知,A→B发生三氯取代,即B为 .
.
(1)A为 ,名称对二甲苯,故答案为:对二甲苯;
,名称对二甲苯,故答案为:对二甲苯;
(2)由A生成B的反应类型是取代反应,由C生成D的反应类型是氧化反应,
故答案为:取代反应;氧化反应;
(3)由B生成C的化学方程式为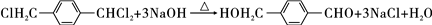 ,该反应过程中生成的不稳定中间体的结构简式应是:
,该反应过程中生成的不稳定中间体的结构简式应是: ,
,
故答案为: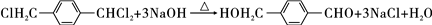 ;
; ;
;
(4)D为 ,分子式为C8H8O3;D的同分异构体中,满足下列条件:
,分子式为C8H8O3;D的同分异构体中,满足下列条件:
①仅含有苯环,无其他环状结构;
②遇三氯化铁溶液显紫色,说明含有酚羟基;
③1mol能与3mol金属钠反应生成1.5mol氢气,应含有3个-OH,则还含有一个CH=CH2,3个-OH为连位,则-CH=CH2有2种位置,3个-OH为偏位,则-CH=CH2有3种位置,3个-OH为均位,则CH=CH2有1种位置,共6有种,其中核磁共振氢谱表明分子中有5种氢,且其峰面积之比为2:2:2:1的结构简式为 ,
,
故答案为:C8H8O3;6; .
.
点评 本题考查有机物的合成,利用逆推法结合碳链骨架、官能团的性质解答,A、B、C的转化结合信息②来推断,较好的考查学生分析推理能力.

练习册系列答案
相关题目
1.下列有关钠及其化合物的说法不正确的是( )
| A. | 电解饱和食盐水可制取金属钠 | |
| B. | 钠与氧气反应的产物与反应条件有关 | |
| C. | 氧化钠与水反应生成氢氧化钠 | |
| D. | 钠可以从四氯化钛中置换出钛 |
19.近年我国科学家在青篙素应用领域取得重大进展,如利用下述反应过程可以制取治疗疟疾的首选药青蒿琥酯.下列有关说法正确的是( )
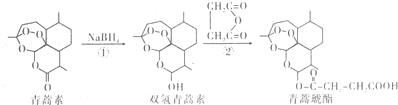

| A. | 青蒿素分子中所有碳原子在同一平面内 | |
| B. | 反应①属于还原反应,反应②理论上原子利用率可达100% | |
| C. | 双氢青蒿素属于芳香化合物 | |
| D. | 青蒿琥酯可以发生水解、酯化以及加聚反应 |
6.化学与生产、生活 密切相关,背景材料:
①浙大研制的石墨烯弹性气凝胶(又名碳海锦)入选2013年度世界最轻固体材料;
②2014年11月上旬北京APEC峰会期间,政府重拳整治雾霾,蓝天重现;
③用属铂丝或无锈铁丝可用来进行钠、钾、铜、钡、锶等的焰色反应
④瑞典皇家理工学院(KTH)的研究人员已经成功地构建出了一种能使水快速分解的分子催化剂.
下列说法不正确的是( )
①浙大研制的石墨烯弹性气凝胶(又名碳海锦)入选2013年度世界最轻固体材料;
②2014年11月上旬北京APEC峰会期间,政府重拳整治雾霾,蓝天重现;
③用属铂丝或无锈铁丝可用来进行钠、钾、铜、钡、锶等的焰色反应
④瑞典皇家理工学院(KTH)的研究人员已经成功地构建出了一种能使水快速分解的分子催化剂.
下列说法不正确的是( )
| A. | 石墨烯弹性气凝胶可用作处理海上原油泄漏的吸油材料 | |
| B. | 压减燃煤、严格控车、调整产业是治理雾霾有效措施 | |
| C. | 绚丽缤纷的烟花中添加了含钾、钠、铁、铜等金属化合物 | |
| D. | 该分子催化剂可将一次能源太阳能直接转化成二次能源 |
16.向含有0.2molFeI2的溶液中加入a molBr2.下列叙述不正确的是( )
| A. | 当a=0.1时,发生的反应为2I-+Br2═I2+2Br- | |
| B. | 当a=0.25时,发生的反应为2Fe2++4I-+3Br2═2Fe3++2I2+6Br- | |
| C. | 当溶液中I-有一半被氧化时,c(I-):c(Br-)=1:1 | |
| D. | 当0.2<a<0.3时,溶液中各离子浓度的关系为2c(Fe2+)+3c(Fe3+)+c(H+)═c(Br-)+c(OH-) |
3.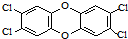 二噁英是一类芳香族化合物的多氯代衍生物的总称,结构稳定,难以被自然分解,是公认的最危险的致癌物质之一.如图是其中一种的结构.下列说法中不正确的是
二噁英是一类芳香族化合物的多氯代衍生物的总称,结构稳定,难以被自然分解,是公认的最危险的致癌物质之一.如图是其中一种的结构.下列说法中不正确的是
( )
 二噁英是一类芳香族化合物的多氯代衍生物的总称,结构稳定,难以被自然分解,是公认的最危险的致癌物质之一.如图是其中一种的结构.下列说法中不正确的是
二噁英是一类芳香族化合物的多氯代衍生物的总称,结构稳定,难以被自然分解,是公认的最危险的致癌物质之一.如图是其中一种的结构.下列说法中不正确的是( )
| A. | 它能发生还原反应 | B. | 它能燃烧 | ||
| C. | 它的一溴取代物只有一种 | D. | 此分子中共平面的原子最多有18个 |
20.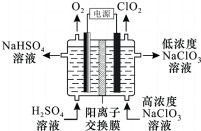 ClO2是高效杀菌消毒剂.用惰性电极电解NaC1O3溶液制备高纯C1O2的原理如下图所示.下列说法正确的是( )
ClO2是高效杀菌消毒剂.用惰性电极电解NaC1O3溶液制备高纯C1O2的原理如下图所示.下列说法正确的是( )
 ClO2是高效杀菌消毒剂.用惰性电极电解NaC1O3溶液制备高纯C1O2的原理如下图所示.下列说法正确的是( )
ClO2是高效杀菌消毒剂.用惰性电极电解NaC1O3溶液制备高纯C1O2的原理如下图所示.下列说法正确的是( )| A. | 电解过程中,Na+向阴极区移动 | |
| B. | 电解产生的O2和ClO2在相同条件下的体积比为1:1 | |
| C. | 阴极的电极反应式是ClO3-+H2O+e-=ClO2↑+2OH- | |
| D. | 电解总反应的化学方程式是4NaClO3+4H2SO4$\frac{\underline{\;电解\;}}{\;}$O2↑+4ClO2↑+4NaHSO4+2H2O |