题目内容
1.下列有关钠及其化合物的说法不正确的是( )| A. | 电解饱和食盐水可制取金属钠 | |
| B. | 钠与氧气反应的产物与反应条件有关 | |
| C. | 氧化钠与水反应生成氢氧化钠 | |
| D. | 钠可以从四氯化钛中置换出钛 |
分析 A、电解饱和食盐水可以得到烧碱、氢气和氯气;
B、钠在没有条件下和氧气反应生成氧化钠,在点燃条件下,和氧气反应生成淡黄色的过氧化钠;
C、氧化钠是碱性氧化物与水反应生成碱;
D、Na是活泼金属,具有强还原性.
解答 解:A、电解饱和食盐水可以得到烧碱、氢气和氯气,电解熔融的氯化钠可以获得金属钠,故A错误;
B、钠在没有条件下和氧气反应生成氧化钠,在点燃条件下,和氧气反应生成淡黄色的过氧化钠,故B正确;
C、氧化钠是碱性氧化物与水反应生成碱,所以氧化钠与水反应生成氢氧化钠,故C正确;
D、Na是活泼金属,具有强还原性,所以用钠从四氯化钛中置换钛,利用了钠的强还原性,故D正确.
故选A.
点评 本题涉及金属的冶炼知识,不同金属的活泼性不同,冶炼方法也不一样,注意知识的归纳和整理是关键,难度不大.

练习册系列答案
相关题目
15.甲、乙、丙、丁、戊五种物质中,甲、乙、丙中均含有某种相同的元素,它们之间具有如右图所示转化关系(反应条件及部分产物已略去),下列有关物质的推断不正确的是( )


| A. | 假设:甲为Al(OH)3;结论:丁可能是盐酸 | |
| B. | 假设:甲为Na2CO3溶液;结论:戊可能是CO2 | |
| C. | 假设:甲为Fe;结论:丁可能是盐酸 | |
| D. | 假设:甲为N2;结论:戊可能是氧气 |
16.下列属于非电解质的是( )
| A. | 铜 | B. | 硝酸钾 | C. | 氢氧化钠 | D. | 蔗糖 |
6.下列离子方程式正确的是( )
| A. | 二氧化锰和浓盐酸反应:MnO2+4H++4Cl-=Mn2++2Cl2↑+2H2O | |
| B. | 二氧化硅和氢氧化钠溶液反应:SiO2+2OH-=SiO32-+H2O | |
| C. | 碳酸钡和稀硝酸反应:CO32-+2H+=CO2↑+H2O | |
| D. | 铜和氯化铁溶液反应:Fe3++Cu=Fe2++Cu2+ |
13.下列说法正确的是( )
| A. | MgF2晶体中的化学键是共价键 | |
| B. | 某物质在熔融态能导电,则该物质中一定含有离子键 | |
| C. | N2和Cl2两种分子中,每个原子的最外层都具有8电子稳定结构 | |
| D. | 干冰是分子晶体,其溶于水生成碳酸的过程只需克服分子间作用力 |
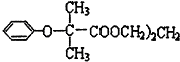 )可用于降低血液中的胆固醇,该物质合成线路如图所示:
)可用于降低血液中的胆固醇,该物质合成线路如图所示: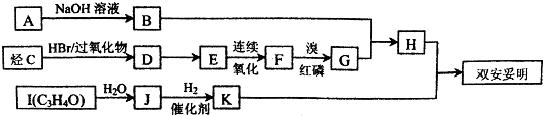
 $\stackrel{苯酚钠}{→}$
$\stackrel{苯酚钠}{→}$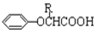
 ,J中所含官能团名称为醛基、羟基.
,J中所含官能团名称为醛基、羟基.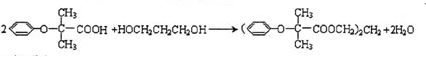 .
.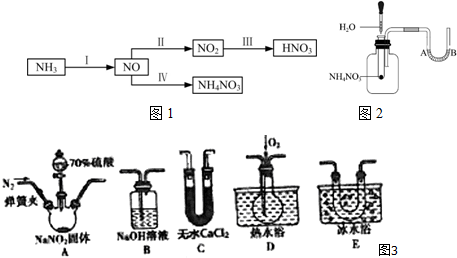
 .
.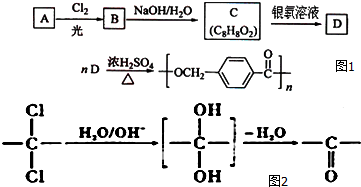
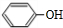
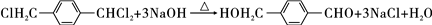 ,该反应过程中生成的不稳定中间体的结构简式应是
,该反应过程中生成的不稳定中间体的结构简式应是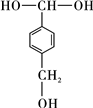 .
.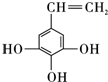 .
.