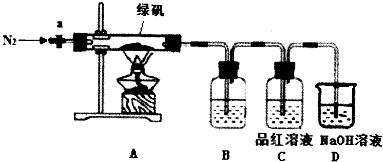
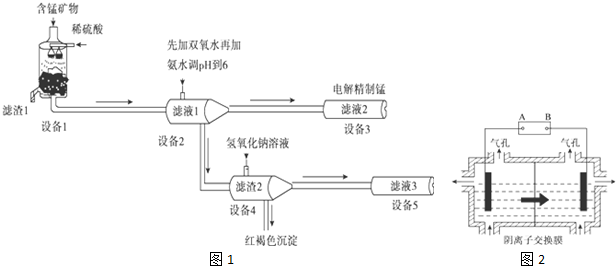
题目内容
20.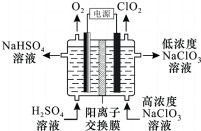 ClO2是高效杀菌消毒剂.用惰性电极电解NaC1O3溶液制备高纯C1O2的原理如下图所示.下列说法正确的是( )
ClO2是高效杀菌消毒剂.用惰性电极电解NaC1O3溶液制备高纯C1O2的原理如下图所示.下列说法正确的是( )| A. | 电解过程中,Na+向阴极区移动 | |
| B. | 电解产生的O2和ClO2在相同条件下的体积比为1:1 | |
| C. | 阴极的电极反应式是ClO3-+H2O+e-=ClO2↑+2OH- | |
| D. | 电解总反应的化学方程式是4NaClO3+4H2SO4$\frac{\underline{\;电解\;}}{\;}$O2↑+4ClO2↑+4NaHSO4+2H2O |
分析 用惰性电极电解NaC1O3溶液制备高纯C1O2的原理:在阳极上是氢氧根离子失电子的氧化反应4OH--4e-═O2+2H2O,在阴极上是NaClO3得电子的还原反应,8H++4ClO3-+4e-═4ClO2↑+4H2O,电解池中,阳离子移向阴极,根据两极反应式来书写总反应方程式.
解答 解:A、电解过程中,阳离子移向阴极,即Na+向阴极区移动,是部分钠离子移向阴极区,故A错误;
B、在阳极上是氢氧根离子失电子的氧化反应4OH--4e-═O2+2H2O,在阴极上是NaClO3得电子的还原反应,8H++4ClO3-+4e-═4ClO2↑+4H2O,电解产生的O2和ClO2在相同条件下的体积比为1:4,故B错误;
C、阴极的电极反应式是8H++4ClO3-+4e-═4ClO2↑+4H2O,故C错误;
D、在阳极上是氢氧根离子失电子的氧化反应4OH--4e-═O2+2H2O,在阴极上是NaClO3得电子的还原反应,8H++4ClO3-+4e-═4ClO2↑+4H2O,电解总反应的化学方程式是4NaClO3+4H2SO4$\frac{\underline{\;通电\;}}{\;}$O2↑+4ClO2↑+4NaHSO4+2H2O,故D正确.
故选D.
点评 本题考查电解原理,为高频考点,把握电极反应为解答的关键,侧重分析与应用能力的考查,注意电解原理的综合应用,题目难度不大.

练习册系列答案
相关题目
8. 室温下,0.2mol•L-1的一元碱BOH与等浓度的盐酸等体积混合后,所得溶液中部分微粒的组分及浓度如图所示,下列对混合溶液的分析正确的是( )
室温下,0.2mol•L-1的一元碱BOH与等浓度的盐酸等体积混合后,所得溶液中部分微粒的组分及浓度如图所示,下列对混合溶液的分析正确的是( )
 室温下,0.2mol•L-1的一元碱BOH与等浓度的盐酸等体积混合后,所得溶液中部分微粒的组分及浓度如图所示,下列对混合溶液的分析正确的是( )
室温下,0.2mol•L-1的一元碱BOH与等浓度的盐酸等体积混合后,所得溶液中部分微粒的组分及浓度如图所示,下列对混合溶液的分析正确的是( )| A. | 溶液可能显中性或酸性 | B. | 升温,c(X)增大,c(Y)减小 | ||
| C. | c(B+)+c(Y)=c(Cl-) | D. | 稀释溶液,c(X)增大,c(Z)增大 |
15.(1)下列关于工业生产说法正确的是BC.(填序号)
A.在侯氏制碱工业中,向饱和氯化钠溶液中先通二氧化碳,后通氨气
B.在硫酸工业、合成氨工业、硝酸工业中,皆采用循环操作提高原料利用率
C.在氯碱工业,电解槽被离子交换膜隔成阴极室和阳极室
D.工业上采用电解熔融氯化铝的方法制取金属铝
E.石油裂化属于化学变化,主要目的是为了获得短链不饱和气态烃
(2)我国规定饮用水质量标准规定必须符合下表中要求:
以下是原水处理成自来水的工艺流程示意图:
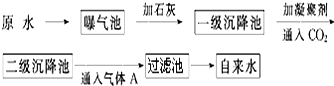
①原水中含Ca2+、Mg2+、HCO3-、Cl-等,加入石灰生成Ca(OH)2,进而发生若干复分解反应,写出其中的离子方程式(只要求写出两个):HCO3-+OH-═CO32-+H2O;Mg2++2OH-═Mg(OH)2↓.
②FeSO4•7H2O是常用的凝聚剂,它在水中最终生成胶状Fe(OH)3沉淀;通入二氧化碳的目的是除去Ca2+和调节pH.
③气体A的作用是杀菌消毒,通常可以用Ca(ClO)2 替代A,下列物质中ac同样可以作为气体A的代用品(填编号,多选倒扣).
a.ClO2 b.浓氨水 c.K2FeO4 d.SO2.
A.在侯氏制碱工业中,向饱和氯化钠溶液中先通二氧化碳,后通氨气
B.在硫酸工业、合成氨工业、硝酸工业中,皆采用循环操作提高原料利用率
C.在氯碱工业,电解槽被离子交换膜隔成阴极室和阳极室
D.工业上采用电解熔融氯化铝的方法制取金属铝
E.石油裂化属于化学变化,主要目的是为了获得短链不饱和气态烃
(2)我国规定饮用水质量标准规定必须符合下表中要求:
| pH | Ca2+、Mg2+总浓度 | 细菌总数 |
| 6.5~8.5 | <0.004 5mol•L-1? | <100个•mL-1? |

①原水中含Ca2+、Mg2+、HCO3-、Cl-等,加入石灰生成Ca(OH)2,进而发生若干复分解反应,写出其中的离子方程式(只要求写出两个):HCO3-+OH-═CO32-+H2O;Mg2++2OH-═Mg(OH)2↓.
②FeSO4•7H2O是常用的凝聚剂,它在水中最终生成胶状Fe(OH)3沉淀;通入二氧化碳的目的是除去Ca2+和调节pH.
③气体A的作用是杀菌消毒,通常可以用Ca(ClO)2 替代A,下列物质中ac同样可以作为气体A的代用品(填编号,多选倒扣).
a.ClO2 b.浓氨水 c.K2FeO4 d.SO2.
5.化学与人类关系密切.下列说法不正确的是( )
| A. | SO2可用于加工食品,使食品增白 | |
| B. | NaOH可用于清洗抽油烟机 | |
| C. | 葡萄糖可用于合成保健药物维生素C | |
| D. | 聚丙烯塑料可用作食品保鲜膜 |
10.a、b、c、d、e均为短周期主族元素,原子序数依次增大,且原子核外L电子层的电子数分别为0、1、5、8、8,d的最高正价与最低负价的绝对值相等,e的最高价氧化物对应的水化物的化学式为HneO2n+2.下列说法正确的是( )
| A. | 单质的沸点:e>d | |
| B. | 原子半径:r(e)>r(d) | |
| C. | 最高价氧化物对应水化物的酸性:c<d | |
| D. | a、b可以形成离子化合物 |
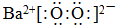 .
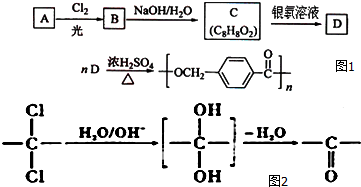
.
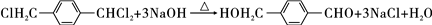 ,该反应过程中生成的不稳定中间体的结构简式应是
,该反应过程中生成的不稳定中间体的结构简式应是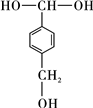 .
. .
.