题目内容
3.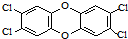 二噁英是一类芳香族化合物的多氯代衍生物的总称,结构稳定,难以被自然分解,是公认的最危险的致癌物质之一.如图是其中一种的结构.下列说法中不正确的是
二噁英是一类芳香族化合物的多氯代衍生物的总称,结构稳定,难以被自然分解,是公认的最危险的致癌物质之一.如图是其中一种的结构.下列说法中不正确的是( )
| A. | 它能发生还原反应 | B. | 它能燃烧 | ||
| C. | 它的一溴取代物只有一种 | D. | 此分子中共平面的原子最多有18个 |
分析 由结构简式可知分子式,分子中含苯环,结构对称,分子中只有一种位置的H,以此来解答.
解答 解:A.含苯环,可发生加成反应,也为还原反应,故A正确;
B.C元素不是最高价态,可燃烧生成二氧化碳、水以及氯化氢,故B正确;
C.有机物结构对称,一溴取代物有一种,故C正确;
D.苯分子中所有原子处于同一平面,连接苯环的醚基与苯环处于同一平面,所以醚基中的氧原子与两个苯环都处于同一平面,所以该分子中所有原子都有可能处于同一平面,故D错误.
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重于学生综合运用化学知识的能力的考查,题目难度不大.

练习册系列答案
相关题目
13.下列说法正确的是( )
| A. | MgF2晶体中的化学键是共价键 | |
| B. | 某物质在熔融态能导电,则该物质中一定含有离子键 | |
| C. | N2和Cl2两种分子中,每个原子的最外层都具有8电子稳定结构 | |
| D. | 干冰是分子晶体,其溶于水生成碳酸的过程只需克服分子间作用力 |
14.化学与生活、社会密切相关.下列说法正确的是( )
| A. | 加碘盐的溶液遇淀粉变蓝 | |
| B. | 汽油和乙烯均为石油分馏得到的产品 | |
| C. | CaO可用作工业废气的脱硫剂 | |
| D. | 蔗糖、淀粉、油脂水解均能生成电解质 |
18.下列实验操作能达到相应实验目的是( )
| 选项 | 实验操作 | 实验目的 |
| A | 将二氧化硫气体通入紫色石蕊试液中,观察溶液颜色变化 | 证明二氧化硫具有漂白性 |
| B | 向2mL 1mol•L-1NaOH溶液中先加入3滴1mol•L-1 FeCl3,再加入3滴1mol•L-1MgCl2溶液 | 证明K[Mg(OH)2]>K[Fe(OH)3] |
| C | 相同条件下,向两支盛有相同体积不同浓度H2O2溶液的试管中分别滴入适量相同浓度的CuSO4溶液和FeCl3溶液 | 探究Cu2+、Fe3+对H2O2分解速率的影响 |
| D | 向2mL品红溶液和2mL加入少许醋酸的品红溶液中分别滴入3滴NaClO的84消毒液,观察红色褪色的快慢 | 证明溶液pH的减少,84消毒液的氧化能力增强 |
| A. | A | B. | B | C. | C | D. | D |
8. 室温下,0.2mol•L-1的一元碱BOH与等浓度的盐酸等体积混合后,所得溶液中部分微粒的组分及浓度如图所示,下列对混合溶液的分析正确的是( )
室温下,0.2mol•L-1的一元碱BOH与等浓度的盐酸等体积混合后,所得溶液中部分微粒的组分及浓度如图所示,下列对混合溶液的分析正确的是( )
 室温下,0.2mol•L-1的一元碱BOH与等浓度的盐酸等体积混合后,所得溶液中部分微粒的组分及浓度如图所示,下列对混合溶液的分析正确的是( )
室温下,0.2mol•L-1的一元碱BOH与等浓度的盐酸等体积混合后,所得溶液中部分微粒的组分及浓度如图所示,下列对混合溶液的分析正确的是( )| A. | 溶液可能显中性或酸性 | B. | 升温,c(X)增大,c(Y)减小 | ||
| C. | c(B+)+c(Y)=c(Cl-) | D. | 稀释溶液,c(X)增大,c(Z)增大 |
15.(1)下列关于工业生产说法正确的是BC.(填序号)
A.在侯氏制碱工业中,向饱和氯化钠溶液中先通二氧化碳,后通氨气
B.在硫酸工业、合成氨工业、硝酸工业中,皆采用循环操作提高原料利用率
C.在氯碱工业,电解槽被离子交换膜隔成阴极室和阳极室
D.工业上采用电解熔融氯化铝的方法制取金属铝
E.石油裂化属于化学变化,主要目的是为了获得短链不饱和气态烃
(2)我国规定饮用水质量标准规定必须符合下表中要求:
以下是原水处理成自来水的工艺流程示意图:
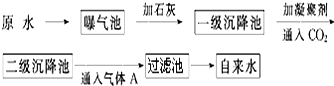
①原水中含Ca2+、Mg2+、HCO3-、Cl-等,加入石灰生成Ca(OH)2,进而发生若干复分解反应,写出其中的离子方程式(只要求写出两个):HCO3-+OH-═CO32-+H2O;Mg2++2OH-═Mg(OH)2↓.
②FeSO4•7H2O是常用的凝聚剂,它在水中最终生成胶状Fe(OH)3沉淀;通入二氧化碳的目的是除去Ca2+和调节pH.
③气体A的作用是杀菌消毒,通常可以用Ca(ClO)2 替代A,下列物质中ac同样可以作为气体A的代用品(填编号,多选倒扣).
a.ClO2 b.浓氨水 c.K2FeO4 d.SO2.
A.在侯氏制碱工业中,向饱和氯化钠溶液中先通二氧化碳,后通氨气
B.在硫酸工业、合成氨工业、硝酸工业中,皆采用循环操作提高原料利用率
C.在氯碱工业,电解槽被离子交换膜隔成阴极室和阳极室
D.工业上采用电解熔融氯化铝的方法制取金属铝
E.石油裂化属于化学变化,主要目的是为了获得短链不饱和气态烃
(2)我国规定饮用水质量标准规定必须符合下表中要求:
| pH | Ca2+、Mg2+总浓度 | 细菌总数 |
| 6.5~8.5 | <0.004 5mol•L-1? | <100个•mL-1? |

①原水中含Ca2+、Mg2+、HCO3-、Cl-等,加入石灰生成Ca(OH)2,进而发生若干复分解反应,写出其中的离子方程式(只要求写出两个):HCO3-+OH-═CO32-+H2O;Mg2++2OH-═Mg(OH)2↓.
②FeSO4•7H2O是常用的凝聚剂,它在水中最终生成胶状Fe(OH)3沉淀;通入二氧化碳的目的是除去Ca2+和调节pH.
③气体A的作用是杀菌消毒,通常可以用Ca(ClO)2 替代A,下列物质中ac同样可以作为气体A的代用品(填编号,多选倒扣).
a.ClO2 b.浓氨水 c.K2FeO4 d.SO2.
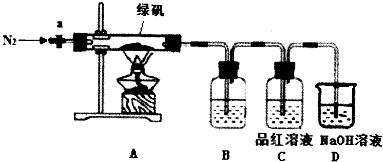
13. 草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸亚铁晶体的化学性质,进行了一系列实验探究.
草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸亚铁晶体的化学性质,进行了一系列实验探究.
(1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到有二氧化碳气体生成.这说明草酸亚铁晶体具有还原性(填“氧化性”、“还原性”或“碱性”).若反应中消耗1mol FeC2O4•2H2O,则参加反应的KMnO4为0.6mol.
(2)资料表明:在密闭容器中加热到一定温度时,草酸亚铁晶体可完全分解,生成几种氧化物,残留物为黑色固体.课题组根据课本上所介绍的铁的氧化物的性质,对黑色固体的组成提出如下假设,请你完成假设二和假设三:
假设一:全部是FeO;
假设二:全部是Fe3O4;
假设三:是FeO和Fe3O4的混合物.
(3)为验证上述假设一是否成立,课题组进行如下研究.
【定性研究】请你完成表中内容.
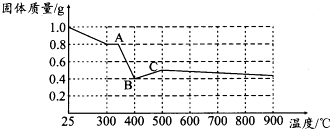
【定量研究】课题组在文献中查阅到,FeC2O4•2H2O受热分解时,固体质量随温度变化的曲线如图所示.写出加热到400℃时,FeC2O4•2H2O晶体受热分解的化学方程式为:FeC2O4•2H2O═FeO+CO2↑+CO↑+2H2O↑.
 草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸亚铁晶体的化学性质,进行了一系列实验探究.
草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸亚铁晶体的化学性质,进行了一系列实验探究.(1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到有二氧化碳气体生成.这说明草酸亚铁晶体具有还原性(填“氧化性”、“还原性”或“碱性”).若反应中消耗1mol FeC2O4•2H2O,则参加反应的KMnO4为0.6mol.
(2)资料表明:在密闭容器中加热到一定温度时,草酸亚铁晶体可完全分解,生成几种氧化物,残留物为黑色固体.课题组根据课本上所介绍的铁的氧化物的性质,对黑色固体的组成提出如下假设,请你完成假设二和假设三:
假设一:全部是FeO;
假设二:全部是Fe3O4;
假设三:是FeO和Fe3O4的混合物.
(3)为验证上述假设一是否成立,课题组进行如下研究.
【定性研究】请你完成表中内容.
| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| 取少量黑色固体,加入适量稀盐酸或稀硫酸, 在溶液中加入硫氰化钾溶液 | 溶液不变红色,则假设一成立, 溶液变成红色,则假设一不成立 |
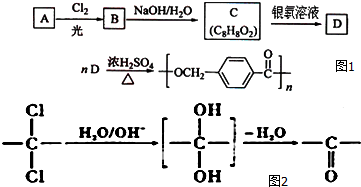
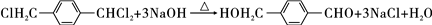 ,该反应过程中生成的不稳定中间体的结构简式应是
,该反应过程中生成的不稳定中间体的结构简式应是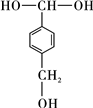 .
.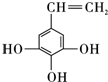 .
.