题目内容
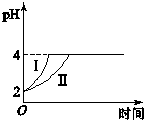 在常温下,取pH=2的盐酸和醋酸溶液各100mL.向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图( )
在常温下,取pH=2的盐酸和醋酸溶液各100mL.向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图( )| A、曲线Ⅰ表示盐酸的pH变化 |
| B、曲线Ⅱ表示盐酸的pH变化 |
| C、在相同条件下,两溶液生成的气体体积相等 |
| D、醋酸溶液中加入锌的质量比盐酸溶液中多 |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:由于醋酸是弱电解质,与Zn反应同时,电离出H+,所以pH变化较缓慢,由图知盐酸和醋酸的pH变化都是由2到4,盐酸中氢离子浓度逐渐减小,但醋酸中存在电离平衡,氢离子和锌反应时促进醋酸电离,补充反应的氢离子,所以醋酸是边反应边电离H+,故消耗的Zn多.
解答:
解:A.由于醋酸是弱电解质,与Zn反应同时,电离出H+,所以pH变化较缓慢,所以II曲线是醋酸溶液的pH变化曲线,I表示盐酸的pH变化,故A正确;
B.由于醋酸是弱电解质,与Zn反应同时,电离出H+,所以pH变化较缓慢,所以II曲线是醋酸溶液的pH变化曲线,I表示盐酸的pH变化,故B错误;
C.由图知盐酸和醋酸的pH变化都是由2到4,盐酸中氢离子浓度逐渐减小,但醋酸中存在电离平衡,氢离子和锌反应时促进醋酸电离,补充反应的氢离子,所以醋酸是边反应边电离H+,故醋酸生成的氢气较多,故C错误;
D.醋酸生成的氢气较多,故醋酸消耗的Zn多,故D正确.
故选AD.
B.由于醋酸是弱电解质,与Zn反应同时,电离出H+,所以pH变化较缓慢,所以II曲线是醋酸溶液的pH变化曲线,I表示盐酸的pH变化,故B错误;
C.由图知盐酸和醋酸的pH变化都是由2到4,盐酸中氢离子浓度逐渐减小,但醋酸中存在电离平衡,氢离子和锌反应时促进醋酸电离,补充反应的氢离子,所以醋酸是边反应边电离H+,故醋酸生成的氢气较多,故C错误;
D.醋酸生成的氢气较多,故醋酸消耗的Zn多,故D正确.
故选AD.
点评:本题考查弱电解质的电离,侧重于学生的分析能力的考查,有利于培养学生的良好的科学素养,提高学生学习的积极性,注意把握弱电解质的电离特点和影响因素,题目难度中等.

练习册系列答案
相关题目
KCl中有少量的KI,为了除去杂质,可选用以下操作中的( )
①加入碘水 ②通入Cl2 ③用CCl4萃取 ④过滤.
①加入碘水 ②通入Cl2 ③用CCl4萃取 ④过滤.
| A、①③ | B、①④ | C、②③ | D、②④ |
下列热化学方程式正确的是(注:△H的绝对值均正确)( )
| A、C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H=-1 367.0 kJ?mol-1(燃烧热) |
| B、Ba(OH)2(aq)+2HCl(aq)═BaCl2(aq)+2H2O(l)△H=-57.3 kJ?mol-1(中和热) |
| C、S(s)+O2(g)═SO2(g)△H=-269.8 kJ?mol-1(反应热) |
| D、2NO2═O2+2NO△H=+116.2 kJ?mol-1(反应热) |
铜和镁的合金4.6g完全溶于浓硝酸,若反应中硝酸被还原只产生4480mL的NO2气体和336mL的N2O4气体(都已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为( )
| A、9.02 g |
| B、8.51 g |
| C、8.26 g |
| D、7.04 g |
如图表示物质通过一步反应的转化关系,下列说法正确的是( )
X(单质或化合物)
酸性氧化物→酸.
X(单质或化合物)
| O2 |
| A、X可能是Al |
| B、X可能是H2 |
| C、酸性氧化物可能是SiO2 |
| D、酸可能是H2SO4 |
下列有关说法正确的是( )
| A、25℃时,pH=5盐酸和pH=9的氨水,两溶液中水的电离程度不同 |
| B、25℃时,Ksp(A)>Ksp(B),说明化合物A的溶解度比化合物B的大 |
| C、常温下pH=4的盐酸中:c(H+)=c(OH-)+c(Cl-) |
| D、在(NH4)2SO4溶液中c(NH4+):c (SO42-)=2:1 |
下列物质不能通过化合反应生成的是( )
| A、NaOH |
| B、NaHCO3 |
| C、FeCl2 |
| D、Al(OH)3 |
现有等浓度的下列溶液,按溶液pH由小到大排列正确的是( )
①醋酸 ②碳酸钠 ③碳酸氢钠 ④碳酸 ⑤醋酸钠.
①醋酸 ②碳酸钠 ③碳酸氢钠 ④碳酸 ⑤醋酸钠.
| A、④①②⑤③ |
| B、④①②⑤③ |
| C、①④⑤③② |
| D、①④②③⑤ |