题目内容
下列有关说法正确的是( )
| A、25℃时,pH=5盐酸和pH=9的氨水,两溶液中水的电离程度不同 |
| B、25℃时,Ksp(A)>Ksp(B),说明化合物A的溶解度比化合物B的大 |
| C、常温下pH=4的盐酸中:c(H+)=c(OH-)+c(Cl-) |
| D、在(NH4)2SO4溶液中c(NH4+):c (SO42-)=2:1 |
考点:pH的简单计算,难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:A.氢离子浓度与氢氧根离子浓度相同时,对水的电离的抑制程度相同;
B.Ksp大溶解度不一定大,与结构有关;
C.根据溶液中存在电荷守恒解答;
D.(NH4)2SO4为强酸弱碱盐,铵根在水溶液中水解.
B.Ksp大溶解度不一定大,与结构有关;
C.根据溶液中存在电荷守恒解答;
D.(NH4)2SO4为强酸弱碱盐,铵根在水溶液中水解.
解答:
解:A.PH=5的盐酸和PH=9的氨水中氢离子浓度与氢氧根离子浓度相同,氢离子浓度与氢氧根离子浓度相同时,对水的电离的抑制程度相同,故A错误;
B.Ksp大溶解度不一定大,与结构有关,故B错误;
C.溶液中存在电荷守恒,阳离子所带的正电荷总数等于阴离子所带的负电荷总数,常温下pH=4的盐酸中:c(H+)=c(OH-)+c(Cl-),故C正确;
D.(NH4)2SO4为强酸弱碱盐,铵根在水溶液中水解,c(NH4+):c (SO42-)<2:1,故D错误;
故选C.
B.Ksp大溶解度不一定大,与结构有关,故B错误;
C.溶液中存在电荷守恒,阳离子所带的正电荷总数等于阴离子所带的负电荷总数,常温下pH=4的盐酸中:c(H+)=c(OH-)+c(Cl-),故C正确;
D.(NH4)2SO4为强酸弱碱盐,铵根在水溶液中水解,c(NH4+):c (SO42-)<2:1,故D错误;
故选C.
点评:本题考查了溶液的酸碱性、弱电解质的电离,注意根据电荷守恒确定溶液酸碱性,任何电解质溶液中都遵循电荷守恒,与电解质强弱、溶液浓度大小无关,题目难度不大.

练习册系列答案
相关题目
下列说法正确的是(NA代表着阿伏加德罗常数的值)( )
| A、1molNa被完全氧化为Na2O2,失去的电子数为2NA |
| B、常温常压下,16gO3气体含有氧原子数为NA |
| C、常温常压下,22.4LCO2 含有分子数为NA |
| D、18g D2O所含有电子数为10NA |
下列气体中,不能用排空气收集的是( )
| A、NO |
| B、NO2 |
| C、CO2 |
| D、H2 |
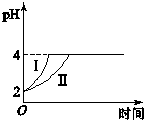 在常温下,取pH=2的盐酸和醋酸溶液各100mL.向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图( )
在常温下,取pH=2的盐酸和醋酸溶液各100mL.向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图( )| A、曲线Ⅰ表示盐酸的pH变化 |
| B、曲线Ⅱ表示盐酸的pH变化 |
| C、在相同条件下,两溶液生成的气体体积相等 |
| D、醋酸溶液中加入锌的质量比盐酸溶液中多 |
下列热化学方程式书写正确的是( )
A、2SO2+O2
| ||||
| B、N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol | ||||
| C、C(s)+O2(g)=CO2(g)△H=+393.5kJ/mol | ||||
D、H2O(l)═H2(g)↑+
|
表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG=lg
,则下列叙述正确的是( )
| c(H+) |
| c(OH) |
| A、中性溶液的AG=0 |
| B、常温下0.lmol/L氢氧化钠溶液AG=12 |
| C、酸性溶液的AG<0 |
| D、常温下0.lmol/L盐酸溶液的AG=12 |
同种物质中同一价态的元素部分被氧化,部分被还原的氧化还原反应是( )
A、MnO2+4HCl(浓)
| ||||
| B、3Br2+6KOH═5KBr+KBrO3+3H2O | ||||
C、2KNO3
| ||||
D、NH4NO3
|
下列说法正确的是( )
| A、22.4L氧气中一定含有6.02×1023个氧分子 |
| B、18g水在标准状况下的体积是22.4L |
| C、标准状况下,20mL NH3与60mL O2所含的分子数之比为1:3 |
| D、金属元素只能存在于阳离子中 |