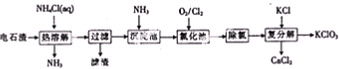
题目内容
下列物质不能通过化合反应生成的是( )
| A、NaOH |
| B、NaHCO3 |
| C、FeCl2 |
| D、Al(OH)3 |
考点:钠的重要化合物,镁、铝的重要化合物,铁的氧化物和氢氧化物
专题:元素及其化合物
分析:A.氧化钠和水反应可生成氢氧化钠;
B.可由碳酸钠和二氧化碳在溶液中生成;
C.铁与氯化铁反应生成氯化亚铁;
D.氧化铝和水不能发生化合反应生成氢氧化铝.
B.可由碳酸钠和二氧化碳在溶液中生成;
C.铁与氯化铁反应生成氯化亚铁;
D.氧化铝和水不能发生化合反应生成氢氧化铝.
解答:
解:A.氧化钠和水反应可生成氢氧化钠,发生化合反应,故A不选;
B.二氧化碳、水和碳酸钠溶液反应生成碳酸氢钠,反应的化学方程式Na2CO3+CO2+H2O═2NaHCO3,故B不选;
C.铁与氯化铁反应生成氯化亚铁,发生化合反应,故C不选;
D.氧化铝和水不能发生化合反应生成氢氧化铝,故D选.
故选D.
B.二氧化碳、水和碳酸钠溶液反应生成碳酸氢钠,反应的化学方程式Na2CO3+CO2+H2O═2NaHCO3,故B不选;
C.铁与氯化铁反应生成氯化亚铁,发生化合反应,故C不选;
D.氧化铝和水不能发生化合反应生成氢氧化铝,故D选.
故选D.
点评:本题综合考查元素化合物知识,明确物质的性质是解本题关键,注意常见物质的性质以及反应类型的判断,学习中注意相关基础知识的积累,难度不大.

练习册系列答案
相关题目
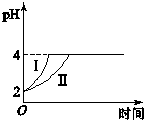 在常温下,取pH=2的盐酸和醋酸溶液各100mL.向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图( )
在常温下,取pH=2的盐酸和醋酸溶液各100mL.向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图( )| A、曲线Ⅰ表示盐酸的pH变化 |
| B、曲线Ⅱ表示盐酸的pH变化 |
| C、在相同条件下,两溶液生成的气体体积相等 |
| D、醋酸溶液中加入锌的质量比盐酸溶液中多 |
表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG=lg
,则下列叙述正确的是( )
| c(H+) |
| c(OH) |
| A、中性溶液的AG=0 |
| B、常温下0.lmol/L氢氧化钠溶液AG=12 |
| C、酸性溶液的AG<0 |
| D、常温下0.lmol/L盐酸溶液的AG=12 |
合成氨所需的氢气由煤与水发生反应制得,其中一步反应为:CO(g)+H2O(g)?CO2(g)+H2(g);△H<0,要使CO转化率提高,可采用下列措施中的( )
| A、增大水蒸气的浓度 |
| B、增大CO的浓度 |
| C、升高温度 |
| D、增大压强 |
同种物质中同一价态的元素部分被氧化,部分被还原的氧化还原反应是( )
A、MnO2+4HCl(浓)
| ||||
| B、3Br2+6KOH═5KBr+KBrO3+3H2O | ||||
C、2KNO3
| ||||
D、NH4NO3
|
下列有关说法正确的是( )
| A、铁表面镀铜时,铜与电源的正极相连,铁与电源的负极相连 |
| B、用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大 |
| C、一定温度下,反应2Mg(s)+CO2(g)=2MgO(s)+C(s)能自发进行,则该反应△H>0 |
| D、SO2(g)+2CO(g)?2CO2(g)+S(l)达到平衡,保持其他条件不变,分离出硫,正反应速率加快,SO2的转化率提高 |
下列变化过程,属于放热反应的是( )
①水蒸气变成液态水
②酸碱中和反应
③浓H2SO4稀释
④固体NaOH溶于水
⑤H2在Cl2中燃烧
⑥弱酸的电离.
①水蒸气变成液态水
②酸碱中和反应
③浓H2SO4稀释
④固体NaOH溶于水
⑤H2在Cl2中燃烧
⑥弱酸的电离.
| A、②③④⑤ | B、②③④ |
| C、②⑤ | D、①②③④⑤ |