题目内容
 (I)CH3+、CH3-、CH3-都是重要的有机反应中间体,有关它们的说法正确的是
(I)CH3+、CH3-、CH3-都是重要的有机反应中间体,有关它们的说法正确的是A.它们均由甲烷去掉一个氢原子所得
B.它们互为等电子体,碳原子均采取sp2杂化
C.CH3-与NH3、H3O+互为等电子体,几何构型均为三角锥形
D.CH3+中的碳原子采取sp2杂化,所有原子均共面
E.两个CH3-或一个CH3+和CH3-结合均可得到CH3CH3
(II)锌是一种重要的金属,锌及其化合物有着广泛的应用.
(1)指出锌在周期表中的位置:
(2)葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂.写出Zn2+基态电子排布式
(3)Zn2+能与NH3形成配离子[Zn(NH3)4]2+.配位体NH3分子属于
(4)图2表示锌与某非金属元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为
考点:晶胞的计算,元素周期表的结构及其应用,配合物的成键情况
专题:化学键与晶体结构
分析:(I)A.甲烷去掉一个氢原子不能得到CH3+、CH3-;
B.CH3+、CH3-、CH3-分别具有6个、7个和8个价电子,不是等电子体;
C.CH3-与NH3、H3O+均具有10个电子,互为等电子体,所以空间构型相同;
D.CH3+中的碳原子采取sp2杂化;
E.两个CH3-或一个CH3+和CH3-结合都能得到CH3CH3.
(II)①Zn的原子序数是30,在第四周期,ⅡB 族,ds 区;
②葡萄糖里有两种碳原子,葡萄糖是无羟基醛,所以,一种是以sp3杂化(接羟基的碳),一种是以sp2杂化(醛基里的碳);
③同种元素之间形成非极性共价键,不同元素之间形成极性共价键,分子中正负电荷中心不重合,从整个分子来看,电荷的分布是不均匀的,不对称的,这样的分子为极性分子,以极性键结合的双原子一定为极性分子,以极性键结合的多原子分子如结构对称,正负电荷的重心重合,电荷分布均匀,则为非极性分子;[Zn(NH3)4]2+中Zn2+与N之间的化学键是配位键;
④晶胞中锌的个数为4,X的个数为4,化学式为ZnX,该化合物是立体网状结构是原子晶体.
B.CH3+、CH3-、CH3-分别具有6个、7个和8个价电子,不是等电子体;
C.CH3-与NH3、H3O+均具有10个电子,互为等电子体,所以空间构型相同;
D.CH3+中的碳原子采取sp2杂化;
E.两个CH3-或一个CH3+和CH3-结合都能得到CH3CH3.
(II)①Zn的原子序数是30,在第四周期,ⅡB 族,ds 区;
②葡萄糖里有两种碳原子,葡萄糖是无羟基醛,所以,一种是以sp3杂化(接羟基的碳),一种是以sp2杂化(醛基里的碳);
③同种元素之间形成非极性共价键,不同元素之间形成极性共价键,分子中正负电荷中心不重合,从整个分子来看,电荷的分布是不均匀的,不对称的,这样的分子为极性分子,以极性键结合的双原子一定为极性分子,以极性键结合的多原子分子如结构对称,正负电荷的重心重合,电荷分布均匀,则为非极性分子;[Zn(NH3)4]2+中Zn2+与N之间的化学键是配位键;
④晶胞中锌的个数为4,X的个数为4,化学式为ZnX,该化合物是立体网状结构是原子晶体.
解答:
解:(1)A.甲烷分子变成CH3+、CH3-、CH3-时,失去的分别是氢负离子、氢离子和质子,空间构型也不再与原来的分子相同,故A错误;
B.CH3+、CH3-、CH3-分别具有6个、7个和8个价电子,不是等电子体,中心碳原子的价层电子对数不同,故空间构型不同,故B错误;
C.CH3-与NH3、H3O+均具有10个电子,互为等电子体,几何构型均为三角锥形,故C正确;
D.CH3+中的碳原子采取sp2杂化,所有原子均共面,故D正确;
E.两个CH3-或一个CH3+和CH3-结合可得到CH3CH3,故E正确.
故选CDE.
(2)①Zn的原子序数是30,其电子排布式为:1s22s22p63s23p63d104s2,由电子排布式可知该元素为第四周期,第ⅡB族ds区,故答案为:四;ⅡB;ds;
②Zn2+基态电子排布式为:1s22s22p63s23p63d10或[Ar]3d10,葡萄糖里有两种碳原子,葡萄糖是无羟基醛,所以,一种是以sp3杂化(接羟基的碳),一种是以sp2杂化(醛基里的碳),故答案为:1s22s22p63s23p63d10或[Ar]3d10;sp2、sp3;
③配位体NH3分子中正负电荷中心不重合,从整个分子来看,电荷的分布是不均匀的,不对称的,是极性分子;[Zn(NH3)4]2+中Zn2+与N之间的化学键是配位键,
故答案为:极性分子;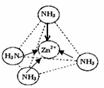 ;
;
④晶胞中锌的个数为4,X的个数为4,化学式为ZnX,该化合物是立体网状结构是原子晶体,而干冰是分子晶体,故该化合物的熔点比干冰高得多,
故答案为:ZnX;该化合物是原子晶体,而干冰是分子晶体.
B.CH3+、CH3-、CH3-分别具有6个、7个和8个价电子,不是等电子体,中心碳原子的价层电子对数不同,故空间构型不同,故B错误;
C.CH3-与NH3、H3O+均具有10个电子,互为等电子体,几何构型均为三角锥形,故C正确;
D.CH3+中的碳原子采取sp2杂化,所有原子均共面,故D正确;
E.两个CH3-或一个CH3+和CH3-结合可得到CH3CH3,故E正确.
故选CDE.
(2)①Zn的原子序数是30,其电子排布式为:1s22s22p63s23p63d104s2,由电子排布式可知该元素为第四周期,第ⅡB族ds区,故答案为:四;ⅡB;ds;
②Zn2+基态电子排布式为:1s22s22p63s23p63d10或[Ar]3d10,葡萄糖里有两种碳原子,葡萄糖是无羟基醛,所以,一种是以sp3杂化(接羟基的碳),一种是以sp2杂化(醛基里的碳),故答案为:1s22s22p63s23p63d10或[Ar]3d10;sp2、sp3;
③配位体NH3分子中正负电荷中心不重合,从整个分子来看,电荷的分布是不均匀的,不对称的,是极性分子;[Zn(NH3)4]2+中Zn2+与N之间的化学键是配位键,
故答案为:极性分子;
 ;
;④晶胞中锌的个数为4,X的个数为4,化学式为ZnX,该化合物是立体网状结构是原子晶体,而干冰是分子晶体,故该化合物的熔点比干冰高得多,
故答案为:ZnX;该化合物是原子晶体,而干冰是分子晶体.
点评:本题考查判断简单分子或离子的构型、极性分子、晶胞的计算、原子轨道杂化方式及杂化类型判断、晶体类型的判断等,难度较大,掌握晶胞的计算是解题的关键.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
下列离子方程式正确的是( )
| A、将过量NaOH溶液滴入Ca(HCO3)2溶液中:Ca2++HCO3-+OH-═CaCO3↓+H2O |
| B、三氯化铁溶液中通入硫化氢气体:2Fe3++3H2S═Fe2S3↓+6H+ |
| C、用稀硝酸浸泡做过银镜反应的试管:Ag+2H++NO3-═Ag++NO2↑+H2O |
| D、4mol?L-1的NaAlO2溶液和7mol?L-1的HCl等体积互相均匀混合:4AlO2-+7H++H2O═3Al(OH)3↓+Al3+ |
NA表示阿伏加德罗常数,下列说法中不正确的是( )
| A、KIO3+6HI=KI+3H2O+3I2,生成3mol I2转移电子的总数为5NA |
| B、标准状况下,5.6L氧气中含有O的总数为0.5NA |
| C、25℃时,pH=13的Ba(OH)2溶液1.0L中含有OH-总数为0.1NA |
| D、20g重水(D2O)中所含电子总数为8NA |
下列各项中,两种物质间反应均产生1mol气体时,参加反应的酸的物质的量最少的是( )
| A、碳与浓硝酸 |
| B、铜与浓硫酸 |
| C、锌与稀硫酸 |
| D、二氧化锰与浓盐酸 |
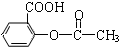 ).为测定某解热镇痛药阿斯
).为测定某解热镇痛药阿斯 冷却后用0.10mol/L HCl溶液返滴过量的NaOH,消耗该HCl溶液25.00mL.
冷却后用0.10mol/L HCl溶液返滴过量的NaOH,消耗该HCl溶液25.00mL.


