题目内容
硫元素有多种化合价,可形成多种化合物.
(1)SO2是形成酸雨的罪魁祸首,一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
2CO(g)+SO2(g)
2CO2(g)+S(1)△H
已知2CO(g)+O2(g)═2CO2(g)△H1═-566kJ?mol-1
S(1)+O2(g)═SO2(g)△H2═-296kJ?mol-1
则反应热△H= kJ?mol-1
(2)常温下用1mol?L-1100mL NaOH溶液恰好完全吸收0.1mol SO2气体,此反应的离子方程式为 ;该溶液pH<7的原因是 (结合方程式回答).
(3)请按照浓度由大到小的顺序排列0.1mol/LNa2SO3溶液中的离子 .Na2SO3溶液放置于空气中一段时间后,溶液的pH (填“增大”“减小”或“不变”).
(4)某同学在常温下设计如下实验流程探究Na2S2O3的化学性质.

实验①可说明 (填字母)
A.该Na2S2O3溶液中水电离的c(OH-)=10-8mol/L
B.H2S2O3是一种弱酸
C.Na2S2O3是一种弱电解质
D.Na2S2O3水解方程式为S2O32-+2H2O?H2S2O3+2OH-
写出实验②发生反应的离子方程式 .
(1)SO2是形成酸雨的罪魁祸首,一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
2CO(g)+SO2(g)
| ||
已知2CO(g)+O2(g)═2CO2(g)△H1═-566kJ?mol-1
S(1)+O2(g)═SO2(g)△H2═-296kJ?mol-1
则反应热△H=
(2)常温下用1mol?L-1100mL NaOH溶液恰好完全吸收0.1mol SO2气体,此反应的离子方程式为
(3)请按照浓度由大到小的顺序排列0.1mol/LNa2SO3溶液中的离子
(4)某同学在常温下设计如下实验流程探究Na2S2O3的化学性质.

实验①可说明
A.该Na2S2O3溶液中水电离的c(OH-)=10-8mol/L
B.H2S2O3是一种弱酸
C.Na2S2O3是一种弱电解质
D.Na2S2O3水解方程式为S2O32-+2H2O?H2S2O3+2OH-
写出实验②发生反应的离子方程式
考点:热化学方程式,离子浓度大小的比较,二氧化硫的化学性质,含硫物质的性质及综合应用
专题:基本概念与基本理论,元素及其化合物
分析:(1)依据盖斯定律结合热化学方程式计算所得热化学方程式得到反应焓变;
(2)1mol?L-1100mL NaOH溶液恰好完全吸收0.1mol SO2气体,发生反应的离子方程式为SO2+OH-=HSO3-,亚硫酸氢钠溶液呈酸性,电离大于水解;
(3)Na2SO3溶液显碱性,SO32-存在两步水解,以第一步水解为主,水解程度较小,据此判断离子浓度关系;根据亚硫酸酸根离子的还原性分析;
(4)常温下实验①测定溶液pH=8,说明溶液呈碱性,H2S2O3是一种弱酸,据此分析判断选项;实验②发生反应是利用氯气氧化 硫代硫酸钠为硫酸钠,结合钡离子生成硫酸钡沉淀.
(2)1mol?L-1100mL NaOH溶液恰好完全吸收0.1mol SO2气体,发生反应的离子方程式为SO2+OH-=HSO3-,亚硫酸氢钠溶液呈酸性,电离大于水解;
(3)Na2SO3溶液显碱性,SO32-存在两步水解,以第一步水解为主,水解程度较小,据此判断离子浓度关系;根据亚硫酸酸根离子的还原性分析;
(4)常温下实验①测定溶液pH=8,说明溶液呈碱性,H2S2O3是一种弱酸,据此分析判断选项;实验②发生反应是利用氯气氧化 硫代硫酸钠为硫酸钠,结合钡离子生成硫酸钡沉淀.
解答:
解:(1)已知①2CO(g)+O2(g)=2CO2(g)△H1=-566kJ?mol-1
②S(l)+O2(g)=SO2(g)△H2=-296kJ?mol-1
反应2CO(g)+SO2(g)
2CO2(g)+S(l)可以是①-②所得,所以该反应的焓变△H=-566kJ?mol-1-(-296kJ?mol-1)=-270kJ?mol-1,
故答案为:-270;
(2)溶液中存在HSO3-水解反应为:HSO3-+H2O?H2SO3+OH-,HSO3-在溶液中部分电离出氢离子,其电离的离子方程式为:HSO3-?H++SO32-,pH<7说明NaHSO3溶液显弱酸性,溶液中电离大于水解;
故答案为:HSO3-?H++SO32-,溶液中存在HSO3-水解反应为:HSO3-+H2O?H2SO3+OH-,HSO3-在溶液中部分电离出氢离子,溶液中电离大于水解;
(3)Na2SO3溶液显碱性,SO32-存在两步水解:SO32-+H2O?HSO3-+OH-,HSO3-+H2O?H2SO3+OH-,以第一步水解为主,水解程度较小,则0.1mol/L Na2SO3溶液中的离子浓度顺序为:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+);亚硫酸酸根离子具有较强的还原性,能被空气中的氧气氧化为硫酸根离子,硫酸根离子不水解,则溶液的碱性降低,pH减小;
故答案为:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+);减小;
(4)常温下实验①测定溶液pH=8,说明溶液呈碱性,H2S2O3是一种弱酸,
A.该Na2S2O3溶液pH=8,溶液呈碱性,硫代硫酸根离子水解显碱性,水电离的c(OH-)=10-6mol/L,故A错误;
B.Na2S2O3溶液pH=8,溶液呈碱性,硫代硫酸根离子水解显碱性,证明H2S2O3是一种弱酸,故B正确;
C.Na2S2O3是钠盐是一种强电解质,故C错误;
D.Na2S2O3水解分步进行,反应的离子方程式为S2O32-+H2O?HS2O3-+OH-,HS2O3-+H2O?H2S2O3+OH-,故D错误;
实验②发生反应是利用氯气氧化硫代硫酸钠为硫酸钠,说明Na2S2O3具有还原性,硫酸钠结合钡离子生成硫酸钡沉淀,反应的离子方程式:S2O32-+5H2O+4Cl2+Ba2+=2BaSO4↓+8Cl-+10H+;
故答案为:B;S2O32-+5H2O+4Cl2+Ba2+=2BaSO4↓+8Cl-+10H+.
②S(l)+O2(g)=SO2(g)△H2=-296kJ?mol-1
反应2CO(g)+SO2(g)
| ||
| △ |
故答案为:-270;
(2)溶液中存在HSO3-水解反应为:HSO3-+H2O?H2SO3+OH-,HSO3-在溶液中部分电离出氢离子,其电离的离子方程式为:HSO3-?H++SO32-,pH<7说明NaHSO3溶液显弱酸性,溶液中电离大于水解;
故答案为:HSO3-?H++SO32-,溶液中存在HSO3-水解反应为:HSO3-+H2O?H2SO3+OH-,HSO3-在溶液中部分电离出氢离子,溶液中电离大于水解;
(3)Na2SO3溶液显碱性,SO32-存在两步水解:SO32-+H2O?HSO3-+OH-,HSO3-+H2O?H2SO3+OH-,以第一步水解为主,水解程度较小,则0.1mol/L Na2SO3溶液中的离子浓度顺序为:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+);亚硫酸酸根离子具有较强的还原性,能被空气中的氧气氧化为硫酸根离子,硫酸根离子不水解,则溶液的碱性降低,pH减小;
故答案为:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+);减小;
(4)常温下实验①测定溶液pH=8,说明溶液呈碱性,H2S2O3是一种弱酸,
A.该Na2S2O3溶液pH=8,溶液呈碱性,硫代硫酸根离子水解显碱性,水电离的c(OH-)=10-6mol/L,故A错误;
B.Na2S2O3溶液pH=8,溶液呈碱性,硫代硫酸根离子水解显碱性,证明H2S2O3是一种弱酸,故B正确;
C.Na2S2O3是钠盐是一种强电解质,故C错误;
D.Na2S2O3水解分步进行,反应的离子方程式为S2O32-+H2O?HS2O3-+OH-,HS2O3-+H2O?H2S2O3+OH-,故D错误;
实验②发生反应是利用氯气氧化硫代硫酸钠为硫酸钠,说明Na2S2O3具有还原性,硫酸钠结合钡离子生成硫酸钡沉淀,反应的离子方程式:S2O32-+5H2O+4Cl2+Ba2+=2BaSO4↓+8Cl-+10H+;
故答案为:B;S2O32-+5H2O+4Cl2+Ba2+=2BaSO4↓+8Cl-+10H+.
点评:本题考查了方程式的书写、反应产物定量分析判断,盐类水解应用,离子浓度大小比较方法等,题目综合性较强,难度较大,侧重于考查学生对基础知识的综合应用能力,熟练掌握基础是关键.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
下列物质中,能导电是( )
| A、氯化钠晶体 |
| B、澄清石灰水 |
| C、酒精 |
| D、CO2 |
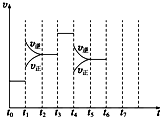 在一密闭容器中发生反应N2+3H2?2NH3△H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:
在一密闭容器中发生反应N2+3H2?2NH3△H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:
 (1)根据VSEPR模型:
(1)根据VSEPR模型: