题目内容
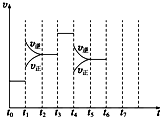 在一密闭容器中发生反应N2+3H2?2NH3△H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:
在一密闭容器中发生反应N2+3H2?2NH3△H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:回答下列问题:
(1)处于平衡状态的时间段是
A.t0~t1 B.t1~t2 C.t2~t3 D.t3~t4 E.t4~t5 F.t5~t6
(2)t1、t3、t4时刻分别改变的一个条件是(填选项).
A.增大压强 B.减小压强 C.升高温度
D.降低温度 E.加催化剂 F.充入氮气
t1时刻
(3)依据(2)中的结论,下列时间段中,氨的百分含量最高的是
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
(4)一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20%,则反应后与反应前的混合气体体积之比为
考点:化学反应速率变化曲线及其应用,化学平衡的影响因素,化学平衡的计算
专题:化学平衡专题
分析:(1)根据图示结合v正=v逆,判断是否处于平衡状态;
(2)由图可知,t1正逆反应速率均增大,且逆反应速率大于正反应速率;t4时正逆反应速率均减小,且逆反应速率大于正反应速率;
(3)由图可知,t1平衡逆向移动,t3不移动,t4平衡逆向移动,根据移动结果分析;
(4)设反应前加入a mol N2,b mol H2,达平衡时生成2x mol NH3,根据三段式和氨气的体积分数计算.
(2)由图可知,t1正逆反应速率均增大,且逆反应速率大于正反应速率;t4时正逆反应速率均减小,且逆反应速率大于正反应速率;
(3)由图可知,t1平衡逆向移动,t3不移动,t4平衡逆向移动,根据移动结果分析;
(4)设反应前加入a mol N2,b mol H2,达平衡时生成2x mol NH3,根据三段式和氨气的体积分数计算.
解答:
解:(1)根据图示可知,t0~t1、t2~t3、t3~t4、t5~t6时间段内,v正、v逆相等,反应处于平衡状态,故答案为:ACDF;
(2)由N2(g)+3H2(g)?2NH3(g)△H<0,可知,该反应为放热反应,且为气体体积减小的反应,则由图可知,t1正逆反应速率均增大,且逆反应速率大于正反应速率,改变条件应为升高温度;
t4时正逆反应速率均减小,且逆反应速率大于正反应速率,改变条件应为减小压强,
故答案为:C;B;
(3)由图可知,t1平衡逆向移动,t3不移动,t4平衡逆向移动,均使氨气的含量减少,则t0~t1氨气的含量最大,
故答案为:A;
(4)设反应前加入a mol N2,b mol H2,达平衡时生成2x mol NH3,
N2(g)+3H2(g)?2NH3(g)
起始 a b 0
转化 x 3x 2x
平衡 a-x b-3x 2x
则反应后气体总的物质的量=(a+b-2x)mol,
=0.2,解得:a+b=12x,故反应后与反应前的混合气体体积之比=
=
=
,
故答案为:5:6.
(2)由N2(g)+3H2(g)?2NH3(g)△H<0,可知,该反应为放热反应,且为气体体积减小的反应,则由图可知,t1正逆反应速率均增大,且逆反应速率大于正反应速率,改变条件应为升高温度;
t4时正逆反应速率均减小,且逆反应速率大于正反应速率,改变条件应为减小压强,
故答案为:C;B;
(3)由图可知,t1平衡逆向移动,t3不移动,t4平衡逆向移动,均使氨气的含量减少,则t0~t1氨气的含量最大,
故答案为:A;
(4)设反应前加入a mol N2,b mol H2,达平衡时生成2x mol NH3,
N2(g)+3H2(g)?2NH3(g)
起始 a b 0
转化 x 3x 2x
平衡 a-x b-3x 2x
则反应后气体总的物质的量=(a+b-2x)mol,
| 2x |
| a+b-2x |
| a+b-2x |
| a+b |
| 12x-2x |
| 12x |
| 5 |
| 6 |
故答案为:5:6.
点评:本题考查影响化学反应速率的因素,注意把握反应的特点及图象分析是解答的关键,明确温度、压强、催化剂对反应速率的影响即可解答,题目难度不大.

练习册系列答案
相关题目
取等质量的有机物A两份,一份与足量的金属钠反应,收集到的气体体积为V1 L;另一份与足量的小苏打溶液反应,收集到的气体体积为V2 L,在相同条件下,2V1=V2,则A的结构简式可能是( )
| A、HOCH2CH2COOH |
| B、HOOC-CH2CH(OH)CH2COOH |
| C、HOOC-COOH |
| D、HOCH2CH2CH2OH |


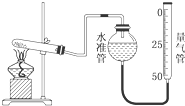 某学生利用高锰酸钾分解制氧气的反应,测定室温下的气体摩尔体积,实验装置如图所示.部分实验步骤:①装好实验装置.②…③把适量的高锰酸钾粉末放入干燥的试管中,准确称量试管和高锰酸钾粉末的质量为a g.④加热,开始反应,直到产生一定量的气体.⑤停止加热.⑥测量收集到的气体的体积.⑦准确称量试管和残留物的质量为b g.⑧测量实验室的温度.回答下列问题.
某学生利用高锰酸钾分解制氧气的反应,测定室温下的气体摩尔体积,实验装置如图所示.部分实验步骤:①装好实验装置.②…③把适量的高锰酸钾粉末放入干燥的试管中,准确称量试管和高锰酸钾粉末的质量为a g.④加热,开始反应,直到产生一定量的气体.⑤停止加热.⑥测量收集到的气体的体积.⑦准确称量试管和残留物的质量为b g.⑧测量实验室的温度.回答下列问题.