题目内容
如图是一个电化学过程的示意图,请回答下列问题:
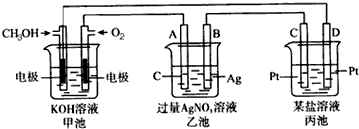
(1)图中甲池是 (填“原电池”、“电解池”或“电镀池”).
(2)B电极的名称是 (填“正极”、“负极”、“阴极”或“阳极”).
(3)写出通入CH3OH的电极的电极反应式: .
(4)乙池中反应的化学方程式为 ,当乙池中B(Ag)极质量增加5.4 g,甲池中理论上消耗O2的体积为 L(标准状况),此时丙池中某电极析出1.6 g某金属,则丙池中的某盐溶液可能是 .
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3
(5)在直接以甲醇为燃料的电池中,电解质溶液为碱性,总反应为:2CH3OH+3O2+4OH-═2CO32-+6H2O,负极的反应式为 .

(1)图中甲池是
(2)B电极的名称是
(3)写出通入CH3OH的电极的电极反应式:
(4)乙池中反应的化学方程式为
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3
(5)在直接以甲醇为燃料的电池中,电解质溶液为碱性,总反应为:2CH3OH+3O2+4OH-═2CO32-+6H2O,负极的反应式为
考点:原电池和电解池的工作原理,化学电源新型电池
专题:电化学专题
分析:(1)甲池能自发的进行氧化还原反应,所以属于原电池;
(2)乙是电解池,通甲醇的负极相连为阴极,和阴极相连的是阳极;
(3)燃料电池的负极上是燃料发生失电子的氧化反应;
(4)根据电解池的工作原理结合电子守恒来计算即可;
(5)燃料电池的负极上是燃料发生失电子的氧化反应,根据电解质环境书写电极方程式.
(2)乙是电解池,通甲醇的负极相连为阴极,和阴极相连的是阳极;
(3)燃料电池的负极上是燃料发生失电子的氧化反应;
(4)根据电解池的工作原理结合电子守恒来计算即可;
(5)燃料电池的负极上是燃料发生失电子的氧化反应,根据电解质环境书写电极方程式.
解答:
解:(1)图中甲池能自发进行氧化还原反应,属于原电池中的燃料电池,故答案为:原电池;
(2)在燃料电池中,通入甲醇的电极为负极、通入氧气的电极为正极,电解池中连接原电池负极的电极为阴极、连接原电池正极的电极为阳极,故答案为:;
(3)通入CH3OH的电极是燃料电池的负极,发生失电子的氧化反应,即CH3OH-6e-+2OH-=CO32-+3H2O,故答案为:CH3OH-6e-+2OH-=CO32-+3H2O;
(4)根据电解池的工作原理,电解硝酸银溶液的反应为:4AgNO3+2H2O
4Ag+4HNO3+O2↑,当乙池中B(Ag)极质量增加5.4g,根据电极反应Ag++e-=Ag,转移电子是0.05mol,甲池中通氧气电极的反应为:O2+4e-+2H2O=4OH-,转移电子0.05mol,则消耗n(O2)=
×0.05mol=0.0125mol,消耗O2的体积为0.0125mol×22.4L/mol=0.28L,转移电子0.05mol,此时丙池中某电极析出1.6g某金属,则该金属是铜,故答案为:4AgNO3+2H2O
4Ag+4HNO3+O2↑;0.28;B;
(5)甲醇燃料电池的负极上是燃料甲醇发生失电子的氧化反应,在碱性介质下,电极反应为:CH3OH-6e-+8OH-═6H2O+CO32-,故答案为:CH3OH-6e-+8OH-═6H2O+CO32-.
(2)在燃料电池中,通入甲醇的电极为负极、通入氧气的电极为正极,电解池中连接原电池负极的电极为阴极、连接原电池正极的电极为阳极,故答案为:;
(3)通入CH3OH的电极是燃料电池的负极,发生失电子的氧化反应,即CH3OH-6e-+2OH-=CO32-+3H2O,故答案为:CH3OH-6e-+2OH-=CO32-+3H2O;
(4)根据电解池的工作原理,电解硝酸银溶液的反应为:4AgNO3+2H2O
| ||
| 1 |
| 4 |
| ||
(5)甲醇燃料电池的负极上是燃料甲醇发生失电子的氧化反应,在碱性介质下,电极反应为:CH3OH-6e-+8OH-═6H2O+CO32-,故答案为:CH3OH-6e-+8OH-═6H2O+CO32-.
点评:本题考查学生电解池和原电池的工作原理、电极反应得书写、电子守恒的计算等知识,难度不大,综合性较强.

练习册系列答案
相关题目
现将100mL由NO、CO2、NH3组成的混合气体,依次通过装有浓硫酸的洗气瓶、装有过氧化钠的干燥管,装有蒸馏水的洗气瓶(假设每一步都充分反应),最后无气体剩余,则三种气体的体积比不可能为( )
| A、8:12:5 |
| B、4:2:5 |
| C、4:6:5 |
| D、2:3:5 |

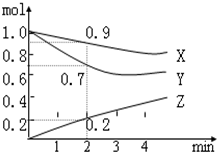 某温度时在2L容器中X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.由图中数据分析:
某温度时在2L容器中X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.由图中数据分析: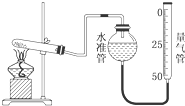 某学生利用高锰酸钾分解制氧气的反应,测定室温下的气体摩尔体积,实验装置如图所示.部分实验步骤:①装好实验装置.②…③把适量的高锰酸钾粉末放入干燥的试管中,准确称量试管和高锰酸钾粉末的质量为a g.④加热,开始反应,直到产生一定量的气体.⑤停止加热.⑥测量收集到的气体的体积.⑦准确称量试管和残留物的质量为b g.⑧测量实验室的温度.回答下列问题.
某学生利用高锰酸钾分解制氧气的反应,测定室温下的气体摩尔体积,实验装置如图所示.部分实验步骤:①装好实验装置.②…③把适量的高锰酸钾粉末放入干燥的试管中,准确称量试管和高锰酸钾粉末的质量为a g.④加热,开始反应,直到产生一定量的气体.⑤停止加热.⑥测量收集到的气体的体积.⑦准确称量试管和残留物的质量为b g.⑧测量实验室的温度.回答下列问题.