题目内容
向四个体积相同的密闭容器(甲、乙、丙、丁)中分别充入一定量的SO2和O2,开始反应时,按反应速率由大到小排列顺序正确的是( )
甲:在500℃时,10mol SO2和6mol O2反应
乙:在500℃时,用V2O5作催化剂,10mol SO2和5mol O2反应
丙:在450℃时,8mol SO2和5mol O2反应
丁:在500℃时,8mol SO2和5mol O2反应.
甲:在500℃时,10mol SO2和6mol O2反应
乙:在500℃时,用V2O5作催化剂,10mol SO2和5mol O2反应
丙:在450℃时,8mol SO2和5mol O2反应
丁:在500℃时,8mol SO2和5mol O2反应.
| A、甲、乙、丙、丁 |
| B、乙、甲、丙、丁 |
| C、乙、甲、丁、丙 |
| D、丁、丙、乙、甲 |
考点:反应速率的定量表示方法
专题:
分析:根据外界条件对反应速率的影响,用控制变量法判断反应速率相对大小,然后排序,注意催化剂对反应速率的影响更大.
解答:
解:甲与乙相比,SO2浓度相等,甲中氧气的浓度大、乙中使用催化剂,其它条件相同,由于二氧化硫的浓度一定,氧气浓度的影响不如催化剂影响大,故使用催化剂反应速率更快,所以反应速率:乙>甲;
甲与丁相比,甲中SO2、O2的物质的量比丁中大,即SO2、O2的浓度比丁中大,其它条件相同,浓度越大,反应速率越快,所以反应速率:甲>丁;
丙与丁相比,其它条件相同,丁中温度高,温度越高,反应速率越快,所以反应速率:丁>丙;
所以由大到小的顺序排列乙、甲、丁、丙,
故选C.
甲与丁相比,甲中SO2、O2的物质的量比丁中大,即SO2、O2的浓度比丁中大,其它条件相同,浓度越大,反应速率越快,所以反应速率:甲>丁;
丙与丁相比,其它条件相同,丁中温度高,温度越高,反应速率越快,所以反应速率:丁>丙;
所以由大到小的顺序排列乙、甲、丁、丙,
故选C.
点评:本题考查化学反应速率的影响因素,难度较小,会用控制变量法探究外界因素对反应速率影响.

练习册系列答案
相关题目
在给定条件下,下列加点的物质在化学反应中完全消耗的是( )
A、用50 mL 12 mol/L的
| ||||||
B、常温下,将1 g
| ||||||
C、向100 mL 3 mol/L的稀硝酸中加入5.6 g
| ||||||
D、常温常压下,0.1 mol
|
 T10C 时,将9molCO2和12molH2充入3L密闭容器中,发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0,容器中CH3OH的物质的量随时间变化如曲线I所示,平衡时容器内压强为P.改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如曲线II所示.下列说法正确的是
T10C 时,将9molCO2和12molH2充入3L密闭容器中,发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0,容器中CH3OH的物质的量随时间变化如曲线I所示,平衡时容器内压强为P.改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如曲线II所示.下列说法正确的是( )
| A、曲线II对应的条件改变是减小压强 |
| B、若T2°C时上述反应的平衡常数为0.42,则T2<T1 |
| C、在T10C,若起始时向容器中充入5 mol CO2、5 mol H2、5 mol CH3OH(g)和 5 mol H2O(g),则达平衡前v(正)>v(逆) |
| D、在T10C,若起始时向容器中通入4.5molCO2、6mol H2,平衡时容器内的压强P1=P/2 |
下列实验装置或操作正确的是( )
A、 向容量瓶中转移液体 |
B、 实验室制取蒸馏水 |
C、 从饱和食盐水中提取NaCl晶体 |
D、 分离酒精和水 |
有A、B、D、E四种金属,当A、B组成原电池时,电子流动方向为A→B;将A、D分别投入等浓度的盐酸中,D比A反应剧烈;用惰性电极电解含有相同浓度的B2+、E2+的溶液时,E2+先被还原.则A、B、D、E金属活泼性由强到弱的顺序为( )
| A、A>B>E>D |
| B、A>B>D>E |
| C、D>E>A>B |
| D、D>A>B>E |
下列关于σ键和π键的理解不正确的是( )
| A、σ键能单独形成,而π键一定不能单独形成 |
| B、σ键可以绕键轴旋转,π键一定不能绕键轴旋转 |
| C、HCl 分子中的σ键是由一个原子的s轨道和另一个原子的p轨道以“头碰头”方式重叠构建而成的 |
| D、气体单质中一定存在σ键,可能存在π键 |

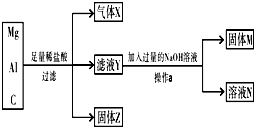 用镁粉、铝粉和炭粉组成的混合物进行如图所示实验,回答下列问题.
用镁粉、铝粉和炭粉组成的混合物进行如图所示实验,回答下列问题.