题目内容
有A、B、D、E四种金属,当A、B组成原电池时,电子流动方向为A→B;将A、D分别投入等浓度的盐酸中,D比A反应剧烈;用惰性电极电解含有相同浓度的B2+、E2+的溶液时,E2+先被还原.则A、B、D、E金属活泼性由强到弱的顺序为( )
| A、A>B>E>D |
| B、A>B>D>E |
| C、D>E>A>B |
| D、D>A>B>E |
考点:常见金属的活动性顺序及其应用,原电池和电解池的工作原理
专题:
分析:一般来说,作原电池负极的金属活动性较强,形成原电池时,电流是从正极流向负极,电子从负极流向正极;金属越活泼,与酸反应越剧烈;在电解池中,阴极上氧化性较强的离子先放电,金属离子的氧化性越强,对应的金属单质越不活泼,以此解答该题.
解答:
解:当A、B组成原电池时,电子流动方向为A→B,则A是原电池的负极,即活泼性A>B;
将A、D分别投入等浓度的盐酸中,D比A反应剧烈,所以活泼性是D>A,
用惰性电极电解含有相同浓度的B2+、E2+的溶液时,E2+先被还原,则金属活泼性B>E,
综上知道金属的活泼性顺序是D>A>B>E,
故选D.
将A、D分别投入等浓度的盐酸中,D比A反应剧烈,所以活泼性是D>A,
用惰性电极电解含有相同浓度的B2+、E2+的溶液时,E2+先被还原,则金属活泼性B>E,
综上知道金属的活泼性顺序是D>A>B>E,
故选D.
点评:本题以金属的活动性的比较为载体考查原电池和电解池知识,侧重于电极反应和放电顺序的考查,注意把握原电池和电解池的工作原理,学习中注意相关基础知识的积累,题目难度不大.

练习册系列答案
相关题目
下列实验操作说法正确的是( )
| A、沾附在试管内壁上的油脂,用热碱液洗涤 |
| B、蒸馏操作时应将温度计的水银球插入液面下 |
| C、苯酚有毒,若其浓溶液不慎沾到皮肤上,应立即用NaOH溶液冲洗 |
| D、向蔗糖溶液中加入几滴稀硫酸,水浴加热,再向其中加入银氨溶液,可产生银镜 |

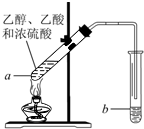 如图,在左试管中先加入3mL的乙醇,并在摇动下缓缓加入2mL浓硫酸,
如图,在左试管中先加入3mL的乙醇,并在摇动下缓缓加入2mL浓硫酸,