题目内容
实验题已知下表数据:
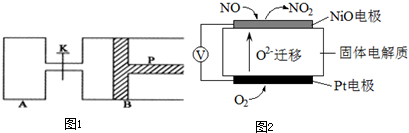
某学生做乙酸乙酯的制备实验
(1)写出该反应的方程式
(2)按装置图安装好仪器后,在大试管中配制好体积比为3:2的乙醇和乙酸,加热至沸腾,很久也没有果香味液体生成,原因是
(3)根据上表数据分析,为什么乙醇需要过量一些,其原因是
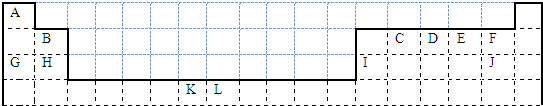
现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图.在图中圆括号表示加入适当的试剂,编号表示适当的分离方法.

(4)写出加入的试剂试剂(a)是 ;试剂(b)是 .
(5)写出有关的操作分离方法①是 ,②是 .
| 物质 | 熔点/℃ | 沸点/℃ | 密度/(g/cm3) |
| 乙醇 | -144 | 78 | 0.789 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸 | -- | 338 | 1.84 |
(1)写出该反应的方程式
(2)按装置图安装好仪器后,在大试管中配制好体积比为3:2的乙醇和乙酸,加热至沸腾,很久也没有果香味液体生成,原因是
(3)根据上表数据分析,为什么乙醇需要过量一些,其原因是
现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图.在图中圆括号表示加入适当的试剂,编号表示适当的分离方法.

(4)写出加入的试剂试剂(a)是
(5)写出有关的操作分离方法①是
考点:乙酸乙酯的制取
专题:实验题
分析:(1)乙酸和乙醇在浓硫酸催化下反应生成乙酸乙酯;
(2)酯化反应需要浓硫酸作催化剂;
(3)依据表中数据可知乙醇沸点低易挥发;
(4)分离物质的原则:所加试剂不与所分离的药品反应,不引入新杂质,分离后的药品容易与被分离的药品分开.加入饱和碳酸钠a溶解乙醇和乙酸反应生成醋酸钠溶液,乙酸乙酯在碳酸钠溶液中不溶分层分液后将乙酸乙酯分离出来,蒸馏混合溶液分离出乙醇,然后向剩余混合液中加入稀硫酸b,稀硫酸与醋酸钠反应生成醋酸和硫酸钠混合溶液,蒸馏将醋酸分离出来;
(5)根据图示流程考虑操作方法.
(2)酯化反应需要浓硫酸作催化剂;
(3)依据表中数据可知乙醇沸点低易挥发;
(4)分离物质的原则:所加试剂不与所分离的药品反应,不引入新杂质,分离后的药品容易与被分离的药品分开.加入饱和碳酸钠a溶解乙醇和乙酸反应生成醋酸钠溶液,乙酸乙酯在碳酸钠溶液中不溶分层分液后将乙酸乙酯分离出来,蒸馏混合溶液分离出乙醇,然后向剩余混合液中加入稀硫酸b,稀硫酸与醋酸钠反应生成醋酸和硫酸钠混合溶液,蒸馏将醋酸分离出来;
(5)根据图示流程考虑操作方法.
解答:
解:(1)乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,同时该反应可逆,反应的化学方程式为
CH3COOH+CH3CH2OH
CH3COOC2H5+H2O.
故答案为:CH3COOH+HOCH2CH3
CH3COOCH2CH3+H2O;
(2)酸与乙醇需浓硫酸作催化剂,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动,若无催化剂,基本看不到反应;
故答案为:故浓硫酸的作用为催化剂,吸水剂.
(3)依据表中数据可知乙醇沸点低易挥发损坏,所以应过量一些,
故答案为:乙醇的沸点低,易挥发而损耗;
(4)加入饱和碳酸钠溶液a,溶解乙醇和乙酸反应生成醋酸钠溶液,乙酸乙酯在碳酸钠溶液中不溶分层分液后将乙酸乙酯分离出来,蒸馏混合溶液分离出乙醇,然后向剩余混合液中加入稀硫酸b,稀硫酸与醋酸钠反应生成醋酸和硫酸钠混合溶液,蒸馏将醋酸分离出来,
故答案为:a饱和碳酸钠,b稀硫酸溶液;
(5)乙酸乙酯在碳酸钠溶液中不溶分层分液后将乙酸乙酯分离出来,蒸馏混合溶液分离出乙醇,
故答案为:分液;蒸馏.
CH3COOH+CH3CH2OH
| 浓硫酸 |
| △ |
故答案为:CH3COOH+HOCH2CH3
| 浓硫酸 |
| △ |
(2)酸与乙醇需浓硫酸作催化剂,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动,若无催化剂,基本看不到反应;
故答案为:故浓硫酸的作用为催化剂,吸水剂.
(3)依据表中数据可知乙醇沸点低易挥发损坏,所以应过量一些,
故答案为:乙醇的沸点低,易挥发而损耗;
(4)加入饱和碳酸钠溶液a,溶解乙醇和乙酸反应生成醋酸钠溶液,乙酸乙酯在碳酸钠溶液中不溶分层分液后将乙酸乙酯分离出来,蒸馏混合溶液分离出乙醇,然后向剩余混合液中加入稀硫酸b,稀硫酸与醋酸钠反应生成醋酸和硫酸钠混合溶液,蒸馏将醋酸分离出来,
故答案为:a饱和碳酸钠,b稀硫酸溶液;
(5)乙酸乙酯在碳酸钠溶液中不溶分层分液后将乙酸乙酯分离出来,蒸馏混合溶液分离出乙醇,
故答案为:分液;蒸馏.
点评:本题考查了实验室制备乙酸乙酯,注意题给信息结合流程图解答.

练习册系列答案
 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目
向四个体积相同的密闭容器(甲、乙、丙、丁)中分别充入一定量的SO2和O2,开始反应时,按反应速率由大到小排列顺序正确的是( )
甲:在500℃时,10mol SO2和6mol O2反应
乙:在500℃时,用V2O5作催化剂,10mol SO2和5mol O2反应
丙:在450℃时,8mol SO2和5mol O2反应
丁:在500℃时,8mol SO2和5mol O2反应.
甲:在500℃时,10mol SO2和6mol O2反应
乙:在500℃时,用V2O5作催化剂,10mol SO2和5mol O2反应
丙:在450℃时,8mol SO2和5mol O2反应
丁:在500℃时,8mol SO2和5mol O2反应.
| A、甲、乙、丙、丁 |
| B、乙、甲、丙、丁 |
| C、乙、甲、丁、丙 |
| D、丁、丙、乙、甲 |
一定条件下,体积为5L的密闭容器中,1molX和1molY进行反应:2X(g)+Y(g)Z(g),经60s达到平衡,生成0.3molZ.下列说法正确的是( )
A、将容器体积变为10L,Z的平衡浓度变为原来的
| ||
| B、以X浓度变化表示的反应速率为0.001mol/(L?S) | ||
| C、若升高温度,X的体积分数增大,则该反应的△H>0 | ||
| D、若增大压强,则物质Y的转化率增大 |
下列除去杂质(括号内的物质)方法正确的是( )
| A、CO2(CO),通入适量O2点燃 |
| B、KNO3溶液(AgNO3),加适量NaCl溶液,过滤 |
| C、NaCl溶液(I2),加酒精,分液 |
| D、除去乙醇中溶解的微量食盐,可以采用蒸馏的方法 |
 能与CH3OH发生酯交换反应生成碳酸二甲酯和另一种醇,写出该反应的化学方程式
能与CH3OH发生酯交换反应生成碳酸二甲酯和另一种醇,写出该反应的化学方程式