题目内容
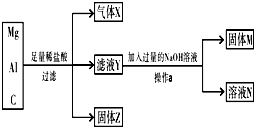 用镁粉、铝粉和炭粉组成的混合物进行如图所示实验,回答下列问题.
用镁粉、铝粉和炭粉组成的混合物进行如图所示实验,回答下列问题.(1)操作a的名称是
(2)气体X为
(3)滤液Y中除H+外,还含有的阳离子为
(4)固体M为
考点:物质分离、提纯的实验方案设计
专题:实验设计题
分析:Mg、Al和C的混合物中加入足量稀盐酸,Mg和Al反应生成氯化物和氢气,所以气体X是H2,C和稀盐酸不反应,所以固体Z是C,滤液为MgCl2、AlCl3,然后向滤液中加入过量NaOH溶液,发生反应MgCl2+2NaOH=Mg(OH)2↓+2NaCl、AlCl3+4NaOH=NaAlO2+3NaCl+2H2O,所以固体M是Mg(OH)2,溶液N中的溶质是NaAlO2、NaCl,以此来解答.
解答:
解:Mg、Al和C的混合物中加入足量稀盐酸,Mg和Al反应生成氯化物和氢气,所以气体X是H2,C和稀盐酸不反应,所以固体Z是C,滤液为MgCl2、AlCl3,然后向滤液中加入过量NaOH溶液,发生反应MgCl2+2NaOH=Mg(OH)2↓+2NaCl、AlCl3+4NaOH=NaAlO2+3NaCl+2H2O,所以固体M是Mg(OH)2,溶液N中的溶质是NaAlO2、NaCl,
(1)操作a分离氢氧化镁和溶液,应为过滤,故答案为:过滤;
(2)通过以上分析知,X是H2,Z是C,故答案为:H2;C;
(3)因盐酸过量,含有氢离子,因为Y溶液中的溶质是氯化镁、氯化铝,所以该溶液中含有的阳离子还有Mg2+、Al3+,故答案为:Mg2+;Al3+;
(4)通过以上分析知,固体M是Mg(OH)2,故答案为:Mg(OH)2.
(1)操作a分离氢氧化镁和溶液,应为过滤,故答案为:过滤;
(2)通过以上分析知,X是H2,Z是C,故答案为:H2;C;
(3)因盐酸过量,含有氢离子,因为Y溶液中的溶质是氯化镁、氯化铝,所以该溶液中含有的阳离子还有Mg2+、Al3+,故答案为:Mg2+;Al3+;
(4)通过以上分析知,固体M是Mg(OH)2,故答案为:Mg(OH)2.
点评:本题以Mg、Al为载体考查混合物的分离提纯实验的设计,为高频考点,把握实验流程中发生的反应及混合物分离方法为解答的关键,明确氢氧化铝的两性,题目难度不大.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案
相关题目
向四个体积相同的密闭容器(甲、乙、丙、丁)中分别充入一定量的SO2和O2,开始反应时,按反应速率由大到小排列顺序正确的是( )
甲:在500℃时,10mol SO2和6mol O2反应
乙:在500℃时,用V2O5作催化剂,10mol SO2和5mol O2反应
丙:在450℃时,8mol SO2和5mol O2反应
丁:在500℃时,8mol SO2和5mol O2反应.
甲:在500℃时,10mol SO2和6mol O2反应
乙:在500℃时,用V2O5作催化剂,10mol SO2和5mol O2反应
丙:在450℃时,8mol SO2和5mol O2反应
丁:在500℃时,8mol SO2和5mol O2反应.
| A、甲、乙、丙、丁 |
| B、乙、甲、丙、丁 |
| C、乙、甲、丁、丙 |
| D、丁、丙、乙、甲 |
一定条件下,体积为5L的密闭容器中,1molX和1molY进行反应:2X(g)+Y(g)Z(g),经60s达到平衡,生成0.3molZ.下列说法正确的是( )
A、将容器体积变为10L,Z的平衡浓度变为原来的
| ||
| B、以X浓度变化表示的反应速率为0.001mol/(L?S) | ||
| C、若升高温度,X的体积分数增大,则该反应的△H>0 | ||
| D、若增大压强,则物质Y的转化率增大 |
下列除去杂质(括号内的物质)方法正确的是( )
| A、CO2(CO),通入适量O2点燃 |
| B、KNO3溶液(AgNO3),加适量NaCl溶液,过滤 |
| C、NaCl溶液(I2),加酒精,分液 |
| D、除去乙醇中溶解的微量食盐,可以采用蒸馏的方法 |

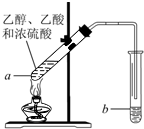 如图,在左试管中先加入3mL的乙醇,并在摇动下缓缓加入2mL浓硫酸,
如图,在左试管中先加入3mL的乙醇,并在摇动下缓缓加入2mL浓硫酸,
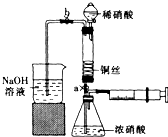 某同学利用下列装置实现铜与浓硝酸、稀硝酸反应,过程如下:
某同学利用下列装置实现铜与浓硝酸、稀硝酸反应,过程如下: