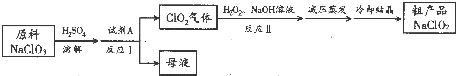
题目内容
17.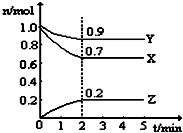 某温度时,在一个5L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空:
某温度时,在一个5L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空:①该反应的化学方程式为3X+Y?2Z.
②反应开始至2min,以气体Z表示的平均反应速率为0.02 mol•L-1•min-1.
③2min反应达平衡容器内混合气体的平均相对分子质量比起始时大(填“大”,“小”或“相等”,下同),混合气体密度比起始时相等.
④上述反应,在第2min时,X的转化率为30%.
分析 ①化学方程式中,反应的物质系数之比等于各个物质的量的变化量之比;
②根据化反应速率v=$\frac{△c}{△t}$来计算反应开始至2min以气体Z表示的平均反应速率;
③混合气体的平均相对分子质量M=$\frac{m}{n}$,混合气体密度ρ=$\frac{m}{V}$来判断;
④2min时X的转化率=$\frac{消耗量}{起始量}$×100%.
解答 解:①根据图示的内容知道,X和Y是反应物,X、Y、Z的变化量之比是(1.0-0.7)mol:(1.0-0.9)mol:0.2mol=3:1:2,该反应的化学方程式为:3X+Y?2Z,
故答案为:3X+Y?2Z;
②反应开始至2min,以气体Z表示的平均反应速率为:v(Z)=$\frac{\frac{0.2mol}{5L}}{2min}$=0.02 mol•L-1•min-1,
故答案为:0.02 mol•L-1•min-1;
③混合气体的平均相摩尔质量M=$\frac{m}{n}$,从开始到平衡气体的总质量不变,但n逐渐减小,所以2min反应达平衡容器内混合气体的平均相对分子质量比起始时大;
混合气体密度ρ=$\frac{m}{V}$,从开始到平衡,质量是守恒的,体积是不变的,所以密度始终不变,
故答案为:大;相等;
④2min时X的转化率=$\frac{1.0mol-0.7mol}{1.0mol}$×100%=30%,
故答案为:30%.
点评 本题考查了化学平衡的计算,题目难度中等,涉及化学反应速率、转化率的计算,明确化学反应速率与化学计量数的关系为解答关键,注意掌握化学平衡图象的分析方法,试题培养了学生的灵活应用能力.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
17.下列指定反应的离子方程式正确的是( )
| A. | 向稀HNO3中滴加Na2SO3溶液:2H++SO32-═SO2↑+H2O | |
| B. | 向Al2(SO4)3溶液中加入过量的NaOH溶液:Al3++3OH-═Al(OH)3↓ | |
| C. | 向0.1mol/L pH=1的KHA溶液中加入KOH溶液:H++OH-═H2O | |
| D. | 用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-═2Mn2++10CO2↑+8H2O |
2.将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s)?2G(g),忽略固体体积,平衡时G的体积分数(%)的温度和压强的变化如下表所示.
①b<f;②915℃,2.0MPa时E的转化率为60%;③该反应的△S>0;④K(1000℃)>K(810℃).
上述①~④中正确的有( )
| 1.0MPa | 2.0MPa | 3.0MPa | |
| 810℃ | 54.0% | a | b |
| 915℃ | c | 75.0% | d |
| 1000℃ | e | f | 83.0% |
上述①~④中正确的有( )
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
9.固体碘化铵置于密闭容器中,加热至一定温度后恒温,容器中发生反应:①NH4I(s)?NH3(g)+HI(g) ②2HI(g)?H2(g)+I2(g),测得平衡时c(I2)=0.5mol/L,反应①的平衡常数为20mol2/L2,则下列结论不正确的是( )
| A. | 平衡时c(NH3)=5mol/L | |
| B. | 平衡时HI分解率为20% | |
| C. | 混合气体的平均摩尔质量不再发生变化不可以作为判断该反应达到平衡状态的标志 | |
| D. | 平衡后缩小容器体积,NH4I的物质的量增加,I2的物质的量不变 |
7.下列说法中,正确的是( )
| A. | 标准状况下,22.4 L水中含有6.02×1023个水分子 | |
| B. | 32 g氧气所含的原子数目为2×6.02×1023 | |
| C. | 常温常压下,0.5×6.02×1023个一氧化碳分子所占的体积是11.2 L | |
| D. | 1 molCaCl2溶于水配成1 L溶液,所得溶液中Cl-的物质的量浓度为1 mol/L |
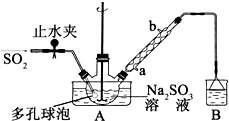 次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O)俗称吊白块,不稳定,120℃时会分解.在印染、医药以及原子能工业中有广泛应用.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:
次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O)俗称吊白块,不稳定,120℃时会分解.在印染、医药以及原子能工业中有广泛应用.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下: