题目内容
20.在一体积固定的密闭容器中加入反应物X、Y,发生如下反应X+2Y?3Z.反应经2min后,X的物质的量浓度从开始的2.0mol/L降为1.6mol/L.已知反应开始时Y的物质的量浓度是2.4mol/L,求:(1)2min末Y、Z的物质的量浓度.
(2)2min内X的平均反应速率.
分析 (1)反应经2min后,X的物质的量浓度从开始的2.0mol/L降为1.6mol/L,则X的浓度变化为:△c(X)=2.0mol/L-1.6mol/L=0.4mol/L,利用化学平衡三段式计算出2min末Y、Z的物质的量浓度;
(2)根据v=$\frac{△c}{△t}$计算2min内X的平均反应速率v(X).
解答 解:(1)反应经2min后X的浓度变化为:△c(X)=2.0mol/L-1.6mol/L=0.4mol/L,
发生反应方程式:X+2Y?3Z
初始(mol/L) 2.0 2.4 0
转化(mol/L) 0.4 0.8 1.2
平衡(mol/L) 1.6 1.6 1.2,
根据分析可知,2min末Y的物质的量浓度为c(Y)=1.6mol/L,2min末Z的物质的量浓度为:c(Z)=1.2mol/L,
答:2min末Y、Z的物质的量浓度分别为1.6mol/L、1.2mol/L;
(2)2min内X的平均反应速率为:v(X)=$\frac{0.4mol/L}{2min}$=0.2mol/(L•min),
答:2min内X的平均反应速率为0.2mol/(L•min).
点评 本题考查了化学平衡的计算,题目难度不大,明确化学平衡三段式的应用方法为解答关键,注意掌握化学反应速率的概念及表达式,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
11.现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2).已知实验中可能会发生下列反应:
①2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO;
②3Mg+N2$\frac{\underline{\;点燃\;}}{\;}$Mg3N2;
③2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C
④Mg+H2O$\frac{\underline{\;\;△\;\;}}{\;}$MgO+H2↑
⑤Mg3N2+6H2O═3Mg(OH)2+2NH3↑
可供选择的装置和药品如下页图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连).

回答下列问题;
在设计实验方案时,除装置A、E外,还应选择的装置(填字母代号)及其目的分别为(可不填满)
(2)连接并检查实验装置的气密性.实验开始时,打开自来水的开关,将空气从5升的储气瓶压入反应装置,则气流流经导管的顺序是(填字母代号)j→h→g→d→c→k→l(或l→k)→a→b (或b→a);
(3)通气后,应先点燃F处的酒精灯,再点燃A处的酒精灯;如果同时点燃A、
F装置的酒精灯,对实验结果有何影响?制得的氮化镁不纯;
(4)请设计一个实验,验证产物是Mg3N2,写出操作步骤、现象和结论:将产物取少量置于试管中,加入适量水,将润湿的红色石蕊试纸置于试管口,如果能够看到润湿的红色石蕊试纸变蓝,则说明产物是氮化镁,若试纸不变蓝,则不含有Mg3N2.
①2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO;
②3Mg+N2$\frac{\underline{\;点燃\;}}{\;}$Mg3N2;
③2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C
④Mg+H2O$\frac{\underline{\;\;△\;\;}}{\;}$MgO+H2↑
⑤Mg3N2+6H2O═3Mg(OH)2+2NH3↑
可供选择的装置和药品如下页图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连).

回答下列问题;
在设计实验方案时,除装置A、E外,还应选择的装置(填字母代号)及其目的分别为(可不填满)
| 装置 | 目的 |
(3)通气后,应先点燃F处的酒精灯,再点燃A处的酒精灯;如果同时点燃A、
F装置的酒精灯,对实验结果有何影响?制得的氮化镁不纯;
(4)请设计一个实验,验证产物是Mg3N2,写出操作步骤、现象和结论:将产物取少量置于试管中,加入适量水,将润湿的红色石蕊试纸置于试管口,如果能够看到润湿的红色石蕊试纸变蓝,则说明产物是氮化镁,若试纸不变蓝,则不含有Mg3N2.
15.实验室制备1,2-二溴乙烷的反应原理如下:
CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2═CH2
CH2═CH2+Br2→BrCH2═CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.用少量溴和足量的乙醇制备1,2二溴乙烷的装置如图所示:
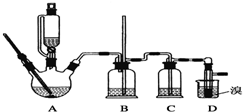
有关数据列表如下:
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d(填正确选项前的字母);
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入c,其目的是吸收反应中可能生成的酸性气体(填正确选项前的字母);
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去.
(4)将1,2二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(5)若产物中有少量副产物乙醚.可用蒸馏的方法除去;
(6)反应过程中应用冷水冷却装置D,其主要目的是冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2═CH2
CH2═CH2+Br2→BrCH2═CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.用少量溴和足量的乙醇制备1,2二溴乙烷的装置如图所示:

有关数据列表如下:
| 乙醇 | 1,2二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d(填正确选项前的字母);
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入c,其目的是吸收反应中可能生成的酸性气体(填正确选项前的字母);
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去.
(4)将1,2二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(5)若产物中有少量副产物乙醚.可用蒸馏的方法除去;
(6)反应过程中应用冷水冷却装置D,其主要目的是冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
9.固体碘化铵置于密闭容器中,加热至一定温度后恒温,容器中发生反应:①NH4I(s)?NH3(g)+HI(g) ②2HI(g)?H2(g)+I2(g),测得平衡时c(I2)=0.5mol/L,反应①的平衡常数为20mol2/L2,则下列结论不正确的是( )
| A. | 平衡时c(NH3)=5mol/L | |
| B. | 平衡时HI分解率为20% | |
| C. | 混合气体的平均摩尔质量不再发生变化不可以作为判断该反应达到平衡状态的标志 | |
| D. | 平衡后缩小容器体积,NH4I的物质的量增加,I2的物质的量不变 |
10.下列关于胶体的叙述中,不正确的是( )
| A. | 可用丁达尔效应区分溶液和胶体 | |
| B. | 将1.0molFeCl3全部制成胶体,其中氢氧化铁胶粒为NA个 | |
| C. | Fe(OH)3胶体的电泳实验说明了胶体粒子带有电荷 | |
| D. | 江河入海口三角洲的形成,通常与胶体的性质有关 |
 次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O)俗称吊白块,不稳定,120℃时会分解.在印染、医药以及原子能工业中有广泛应用.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:
次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O)俗称吊白块,不稳定,120℃时会分解.在印染、医药以及原子能工业中有广泛应用.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下: