题目内容
4.下列有关电化学装置的说法正确的是( )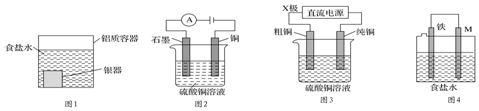
| A. | 用图1装置处理银器表面的黑斑(Ag2S),银器表面发生的反应为Ag2S+2e-═2Ag+S2-,该过程中总反应为2Al+3Ag2S═6Ag+Al2S3 | |
| B. | 用图2装置电解一段时间后,铜电极部分溶解,溶液中铜离子的浓度基本不变 | |
| C. | 图3装置中若直流电源的X极为正极,则该装置可实现粗铜的电解精炼 | |
| D. | 图4装置中若M是铜,则该装置能防止铁被腐蚀 |
分析 A.形成原电池反应,Ag2S为正极被还原,Al2S3在溶液中不能存在,总方程式中不能有Al2S3;
B.铜为阴极,发生还原反应;
C.电解精炼时,粗铜作阳极,纯铜作阴极;
D.Fe、Cu形成原电池时,Fe为负极.
解答 解:A.形成原电池反应,Al为负极,被氧化,Ag2S为正极被还原,正极方程式为Ag2S+2e-=2Ag+S2-,Al2S3在溶液中不能存在,总方程式中不能有Al2S3,反应的总方程式为:2Al+3Ag2S+6H2O═2Al(OH)3↓+6Ag+3H2S↑,故A错误;
B.铜为阴极,铜离子在发生还原反应,Cu电极不能溶解,石墨电极上生成氧气,所以溶液中铜离子浓度减小,故B错误;
C.图3中的X极若为正极,粗铜为阳极,纯铜作阴极,能实现粗铜的电解精炼,故C正确;
D.Fe、Cu形成原电池时,Fe为负极,Fe被腐蚀,Cu为正极,Cu被保护,故D错误.
故选C.
点评 本题考查较为综合,涉及原电池和电解池原理,注意根据金属的腐蚀及保护、粗铜的精炼、电解原理等知识来分析解答,难度不大.

练习册系列答案
 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
15.下列说法正确的是( )
| A. | 常温下,铁能被浓硝酸钝化,可用铁质容器贮运浓硝酸 | |
| B. | 包装食品里常有硅胶、石灰、还原铁粉三类小包,其作用相同 | |
| C. | 浓硫酸可用于干燥H2S和CO2 | |
| D. | 合金的物理性质一般与其各组分金属的物理性质相同 |
12.25℃时,弱酸的电离平衡常数如表,下列说法正确的是( )
| 弱酸 | CH3COOH | HCN | H2CO3 |
| K | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | 等物质的量浓度溶液pH关系:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) | |
| B. | amol/L HCN与bmol/L NaOH溶液等体积混合后所得溶液中c(Na+)>c(CN-),则a一定小于b | |
| C. | 往冰醋酸中逐滴加水,溶液导电能力先增大,后减小 | |
| D. | NaHCO3和Na2CO3的混合液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) |
19.下列变化不属于氧化还原反应的是( )
| A. | 加热氢氧化铁固体 | B. | 金属钠露置于空气中 | ||
| C. | 灼热的铜丝放在氯气中燃烧 | D. | 将氯气通入冷的消石灰浊液中 |
9.短周期主族元素X、Y、Z、W的原子序数依次增大,X元素原子最外层电子数是内层的2倍,Z是地壳中含量最高的元素,W是同周期原子半径最大的金属元素.下列说法正确的是( )
| A. | 原子半径的大小顺序:r(W)>r(Z)>r(Y) | |
| B. | X的最高价氧化物对应水化物的酸性比Y的强 | |
| C. | Z的简单气态氢化物的热稳定性比Y的强 | |
| D. | Z分别与X、W形成的化合物的化学键类型相同 |
16.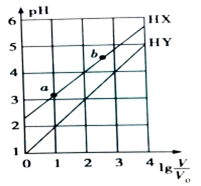 常温下,浓度均为0.1mol•L-1、体积均为V0的HX和HY溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示(不考虑HX、HY和H2O的挥发),下列叙述正确的是( )
常温下,浓度均为0.1mol•L-1、体积均为V0的HX和HY溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示(不考虑HX、HY和H2O的挥发),下列叙述正确的是( )
 常温下,浓度均为0.1mol•L-1、体积均为V0的HX和HY溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示(不考虑HX、HY和H2O的挥发),下列叙述正确的是( )
常温下,浓度均为0.1mol•L-1、体积均为V0的HX和HY溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示(不考虑HX、HY和H2O的挥发),下列叙述正确的是( )| A. | HX和HY都是弱酸,且HX的酸性比HY的弱 | |
| B. | HX的电离程度:a点大于b点 | |
| C. | HX溶液由a点稀释至b点时,由水电离出的c(H+)•c(OH-)不变 | |
| D. | 当lg$\frac{V}{{V}_{0}}$=3时,若两溶液同时升高温度,则$\frac{c({X}^{-})}{c({Y}^{-})}$增大 |
13.将一小块金属钠投入到下列溶液中,既能产生气体又会出现沉淀的是( )
| A. | 稀硫酸 | B. | 碳酸氢钠溶液 | C. | 硫酸铁溶液 | D. | 氯化钠溶液 |