题目内容
16.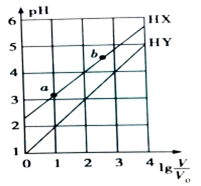 常温下,浓度均为0.1mol•L-1、体积均为V0的HX和HY溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示(不考虑HX、HY和H2O的挥发),下列叙述正确的是( )
常温下,浓度均为0.1mol•L-1、体积均为V0的HX和HY溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示(不考虑HX、HY和H2O的挥发),下列叙述正确的是( )| A. | HX和HY都是弱酸,且HX的酸性比HY的弱 | |
| B. | HX的电离程度:a点大于b点 | |
| C. | HX溶液由a点稀释至b点时,由水电离出的c(H+)•c(OH-)不变 | |
| D. | 当lg$\frac{V}{{V}_{0}}$=3时,若两溶液同时升高温度,则$\frac{c({X}^{-})}{c({Y}^{-})}$增大 |
分析 A.根据图知,lg$\frac{V}{{V}_{0}}$=0时,HX的pH>1,说明HX部分电离为弱电解质,HY的pH=1,说明HY完全电离,为强电解质;
B.HX部分电离为弱电解质,加水稀释促进电离;
C.相同温度下,溶液中离子积常数不变,HX溶液由a点稀释至b点时水的电离程度增大;
D.lg$\frac{V}{{V}_{0}}$=3,若同时微热两种溶液(不考虑HX、HY和H2O的挥发),n(X-)增大,n(Y-)不变,二者溶液体积相等.
解答 解:A.根据图知,lg$\frac{V}{{V}_{0}}$=0时,HX的pH>1,说明HX部分电离为弱电解质,HY的pH=1,说明HY完全电离,为强电解质,HY的酸性大于HX,故A错误;
B.HX部分电离为弱电解质,加水稀释促进电离,HX的电离程度a<b,故B错误;
C.温度不变溶液中离子积常数不变,HX溶液由a点稀释至b点时,水的电离程度增大,由水电离出的c(H+)•c(OH-)增大,故C错误;
D.lg$\frac{V}{{V}_{0}}$=3,若同时微热两种溶液(不考虑HX、HY和H2O的挥发),n(X-)增大,n(Y-)不变,二者溶液体积相等,所以$\frac{\frac{n({X}^{-})}{V}}{\frac{n({Y}^{-})}{V}}$=$\frac{c({X}^{-})}{c({Y}^{-})}$变大,故D正确;
故选D.
点评 本题考查弱电解质电离,为高频考点,侧重考查学生分析推断及识图能力,正确判断两种酸的强弱是解本题关键,注意:酸的电离平衡常数只与温度有关,与溶液浓度无关,易错选项是D.

练习册系列答案
相关题目
7.下列说法正确的是( )
| A. | 1,2-二溴乙烷的结构简式为CH3CHBr2 | |
| B. | 乙酸乙酯的结构式为CH3COOCH2CH3 | |
| C. | 含有乙烯的乙烷通过催化加氢除去乙烯,可得到纯净的乙烷 | |
| D. | 完全燃烧生成等物质的量的 CO2和 H2O的物质不一定是乙烯 |
4.下列有关电化学装置的说法正确的是( )
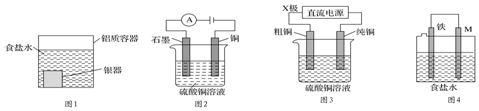

| A. | 用图1装置处理银器表面的黑斑(Ag2S),银器表面发生的反应为Ag2S+2e-═2Ag+S2-,该过程中总反应为2Al+3Ag2S═6Ag+Al2S3 | |
| B. | 用图2装置电解一段时间后,铜电极部分溶解,溶液中铜离子的浓度基本不变 | |
| C. | 图3装置中若直流电源的X极为正极,则该装置可实现粗铜的电解精炼 | |
| D. | 图4装置中若M是铜,则该装置能防止铁被腐蚀 |

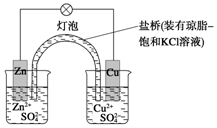 铜锌原电池(如图)工作时
铜锌原电池(如图)工作时 (1)8.4g N2与9.6g某单质Rx所含原子个数相同,且分子数之比为3:2,则R的相对原子质量是16,x值为3.
(1)8.4g N2与9.6g某单质Rx所含原子个数相同,且分子数之比为3:2,则R的相对原子质量是16,x值为3.