题目内容
15.下列说法正确的是( )| A. | 常温下,铁能被浓硝酸钝化,可用铁质容器贮运浓硝酸 | |
| B. | 包装食品里常有硅胶、石灰、还原铁粉三类小包,其作用相同 | |
| C. | 浓硫酸可用于干燥H2S和CO2 | |
| D. | 合金的物理性质一般与其各组分金属的物理性质相同 |
分析 A.浓硝酸具有强氧化性,可使铁钝化;
B.硅胶、石灰是干燥剂;还原铁粉是抗氧化剂;
C.浓硫酸具有强氧化性,氧化H2S;
D.合金与各成分金属相比硬度大熔点低.
解答 解:A.浓硝酸具有强氧化性,可使铁钝化,所以在常温下用铁质容器贮运浓硝酸,故A正确;
B.包装食品里常有硅胶、石灰、还原铁粉三类小包,硅胶、石灰是干燥剂;还原铁粉是抗氧化剂,故B错误;
C.浓硫酸具有强氧化性,氧化H2S,所以浓硫酸不能用于干燥H2S,故C错误;
D.合金的物理性质一般与其各成分金属的物理性质不同,如合金与各成分金属相比硬度大熔点低,故D错误;
故选:A.
点评 本题考查了物质的用途,性质决定用途,明确物质的性质是解题关键,题目难度不大.

练习册系列答案
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
6.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 在使石蕊试液变红的溶液中:Na+、K+、Br-、SO42- | |
| B. | 氯化亚铁溶液中:K+、Al3+、SO42-、MnO4- | |
| C. | 硫酸铝溶液中:K+、AlO2-、Na+、Cl- | |
| D. | 与铝反应产生大量氢气的溶液:NH4+、Na+、SO42-、NO3- |
3.有机物R的分子式为C5H10O2,它能和碳酸氢钠溶液反应产生气体,在光照下,R与氯气发生烃基上氢的取代反应,生成的一氯代物有( )
| A. | 4种 | B. | 8种 | C. | 10种 | D. | 12种 |
10.补充完成下表:
(1)请把序号①一⑦的答案对应填上)
①Na②Cl③ ④
④ ⑤二⑥ⅠA⑦ⅥA
⑤二⑥ⅠA⑦ⅥA
(2)甲元素最高价氧化物对应的水化物呈碱性(填“酸、碱”),乙元素的最高价氧化物对应的水化物的化学式为HClO4.
(3)甲与乙两元素的单质反应生成物的电子式为 ,属于离子(离子或共价)化合物.
,属于离子(离子或共价)化合物.
(4)甲单质与丙的氢化物反应的化学方程式为2Na+2H2O=2NaOH+H2↑.
| 元素 | 甲 | 乙 | 丙 |
| 元素符号 | ① | ② | O |
| 原子结构 示意图 |  | ③ | ④ |
| 周期 | 三 | 三 | ⑤ |
| 族 | ⑥ | ⅦA | ⑦ |
①Na②Cl③
 ④
④ ⑤二⑥ⅠA⑦ⅥA
⑤二⑥ⅠA⑦ⅥA(2)甲元素最高价氧化物对应的水化物呈碱性(填“酸、碱”),乙元素的最高价氧化物对应的水化物的化学式为HClO4.
(3)甲与乙两元素的单质反应生成物的电子式为
 ,属于离子(离子或共价)化合物.
,属于离子(离子或共价)化合物.(4)甲单质与丙的氢化物反应的化学方程式为2Na+2H2O=2NaOH+H2↑.
20.下列对有机物的性质说法正确的是( )
| A. | 乙苯和邻二甲苯属于同分异构体 | |
| B. | 苯和苯乙烯属于同系物 | |
| C. | 糖类和蛋白质都属于天然高分子化合物 | |
| D. | 植物油和矿物油都属于油脂 |
7.下列说法正确的是( )
| A. | 1,2-二溴乙烷的结构简式为CH3CHBr2 | |
| B. | 乙酸乙酯的结构式为CH3COOCH2CH3 | |
| C. | 含有乙烯的乙烷通过催化加氢除去乙烯,可得到纯净的乙烷 | |
| D. | 完全燃烧生成等物质的量的 CO2和 H2O的物质不一定是乙烯 |
4.下列有关电化学装置的说法正确的是( )
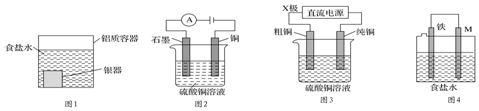

| A. | 用图1装置处理银器表面的黑斑(Ag2S),银器表面发生的反应为Ag2S+2e-═2Ag+S2-,该过程中总反应为2Al+3Ag2S═6Ag+Al2S3 | |
| B. | 用图2装置电解一段时间后,铜电极部分溶解,溶液中铜离子的浓度基本不变 | |
| C. | 图3装置中若直流电源的X极为正极,则该装置可实现粗铜的电解精炼 | |
| D. | 图4装置中若M是铜,则该装置能防止铁被腐蚀 |
