题目内容
12.25℃时,弱酸的电离平衡常数如表,下列说法正确的是( )| 弱酸 | CH3COOH | HCN | H2CO3 |
| K | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | 等物质的量浓度溶液pH关系:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) | |
| B. | amol/L HCN与bmol/L NaOH溶液等体积混合后所得溶液中c(Na+)>c(CN-),则a一定小于b | |
| C. | 往冰醋酸中逐滴加水,溶液导电能力先增大,后减小 | |
| D. | NaHCO3和Na2CO3的混合液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) |
分析 A.酸的电离平衡常数越大,其酸根离子水解程度越小,则相同浓度的钠盐溶液pH越小;
B.等浓度、等体积的HCN和NaOH溶液混合,二者恰好反应生成NaCN,NaCN为强碱弱酸盐,其溶液呈碱性,再结合电荷守恒判断;
C.冰醋酸中逐渐加入水,促进醋酸电离,溶液的导电能力与离子浓度成正比;
D.任何电解质溶液中都存在电荷守恒,根据电荷守恒和物料守恒判断.
解答 解:A.酸的电离平衡常数越大,其酸根离子水解程度越小,则相同浓度的钠盐溶液pH越小,电离平衡常数HCO3-<HCN<H2CO3<CH3COOH,所以水解程度CO32->CN->HCO3->CH3COO-,则相同浓度的钠盐溶液pH大小顺序是:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa),故A错误;
B.等浓度、等体积的HCN和NaOH溶液混合,二者恰好反应生成NaCN,NaCN为强碱弱酸盐,其溶液呈碱性,则c (OH-)>c(H+),根据电荷守恒得c(Na+)>c(CN-),所以c(Na+)>c(CN-)时,则a不一定小于b,故B错误;
C.冰醋酸中逐渐加入水,促进醋酸电离,所以醋酸的电离程度逐渐增大,溶液的导电能力与离子浓度成正比,随着水的加入,氢离子浓度先增大后减小,溶液的导电能力先增大后减小,故C正确;
D.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),NaHCO3和Na2CO3的混合液中溶质物质的量之比不能确定,物料守恒不同角色得到的结果不同,故D错误;
故选C.
点评 本题考查了离子浓度大小比较,涉及弱电解质的电离、盐类水解等知识点,根据溶质的性质结合电荷守恒来分析解答,易错选项是C,会分析加水稀释冰醋酸过程中各种粒子浓度变化、溶液导电能力变化等知识点,题目难度中等.

 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案| A. | 4种 | B. | 8种 | C. | 10种 | D. | 12种 |
| A. | 乙苯和邻二甲苯属于同分异构体 | |
| B. | 苯和苯乙烯属于同系物 | |
| C. | 糖类和蛋白质都属于天然高分子化合物 | |
| D. | 植物油和矿物油都属于油脂 |
| A. | 1,2-二溴乙烷的结构简式为CH3CHBr2 | |
| B. | 乙酸乙酯的结构式为CH3COOCH2CH3 | |
| C. | 含有乙烯的乙烷通过催化加氢除去乙烯,可得到纯净的乙烷 | |
| D. | 完全燃烧生成等物质的量的 CO2和 H2O的物质不一定是乙烯 |
| A. | 热还原法 | B. | 分解法 | C. | 电解法 | D. | 富集法 |
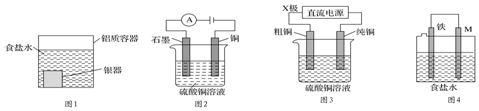
| A. | 用图1装置处理银器表面的黑斑(Ag2S),银器表面发生的反应为Ag2S+2e-═2Ag+S2-,该过程中总反应为2Al+3Ag2S═6Ag+Al2S3 | |
| B. | 用图2装置电解一段时间后,铜电极部分溶解,溶液中铜离子的浓度基本不变 | |
| C. | 图3装置中若直流电源的X极为正极,则该装置可实现粗铜的电解精炼 | |
| D. | 图4装置中若M是铜,则该装置能防止铁被腐蚀 |
 铜锌原电池(如图)工作时
铜锌原电池(如图)工作时