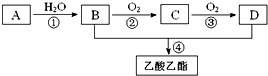
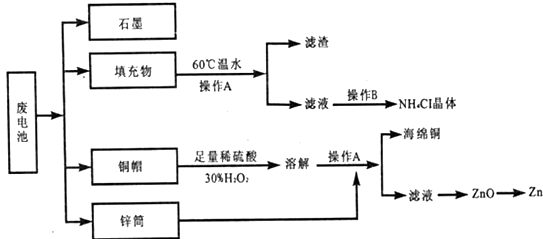
题目内容
19.A、B、C三种元素的原子核外具有相同的电子层数,其最高价氧化物对应水化物的酸性强弱顺序是 HAO4>H2BO4>H3CO4,则下列判断中错误的是( )| A. | 原子半径 A>B>C | B. | 气态氢化物的稳定性HA>H2B>H3C | ||
| C. | 阴离子还原性C3->B2->A- | D. | 非金属性A>B>C |
分析 同周期元素从左到右元素的非金属性逐渐增强,对应最高价氧化物对应水化物的酸性逐渐增强,同周期的A、B、C三元素,其最高价氧化物对应水化物的酸性强弱顺序是HAO4>H2BO4>H3CO4,则非金属性:A>B>C,原子序数:A>B>C,结合元素周期律的递变规律进行判断.
解答 解:同周期元素从左到右元素的非金属性逐渐增强,对应最高价氧化物对应水化物的酸性逐渐增强,同周期的A、B、C三元素,其最高价氧化物对应水化物的酸性强弱顺序是HAO4>H2BO4>H3CO4,则非金属性:A>B>C,原子序数:A>B>C,则
A.同周期元素原子半径从左到右原子半径逐渐减小,原子序数:A>B>C,则原子半径A<B<C,故A错误;
B.非金属性:A>B>C,非金属性越强,对应氢化物的稳定性越强,则有气态氢化物稳定性HA>H2B>CH3,故B正确;
C.非金属性越强,对应单质的氧化性越强,阴离子的还原性越弱,非金属性A>B>C,则有阴离子还原性C3->B2->A-,故C正确;
D.非金属性越强,对应最高价氧化物对应水化物的酸性越强,已知酸性强弱顺序HAO4>H2BO4>H3CO4,则有非金属性A>B>C,故D错误.
故选D.
点评 本题考查元素周期律知识,为高考常见题型和高频考点,题目难度不大,注意相关性质的比较角度以及元素周期律的主要递变规律.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案
相关题目
9.下列粒子的半径关系正确的是( )
| A. | r(Na)>r(Mg)>r(Al)>r(K) | B. | r(K+)>r(Ca2+)>r(S2-)>r(Cl-) | ||
| C. | r(Na)>r(K)>r(Ca)>r(Mg) | D. | r(F-)>r(Na+)>r(Mg2+)>r(Al3+) |
10.有关如图装置中的叙述正确的是( )
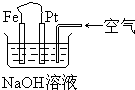

| A. | 这是电解NaOH溶液的装置 | |
| B. | Pt为正极,其电极反应为:O2+2H2O+4eˉ═4OHˉ | |
| C. | Fe为阳极,其电极反应为:Fe-2eˉ+2OHˉ═2Fe(OH)2 | |
| D. | 这是一个原电池装置,利用该装置可长时间的观察到Fe(OH)2沉淀的颜色 |
4. 电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用,其原理如图所示.下列说法正确的是( )
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用,其原理如图所示.下列说法正确的是( )
 电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用,其原理如图所示.下列说法正确的是( )
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用,其原理如图所示.下列说法正确的是( )| A. | 石墨电极上发生氧化反应 | |
| B. | 根据图示,物质A为CO2 | |
| C. | 甲烷燃料电池中CO32-向空气一极移动 | |
| D. | 为增强污水的导电能力,可向污水中加入适量乙醇 |
11.下列实验能获得成功的是( )
| A. | 向苯酚中加浓溴水观察沉淀 | |
| B. | 将乙醛滴入银氨溶液中,加热煮沸制银镜 | |
| C. | 苯与浓溴水反应制取溴苯 | |
| D. | 1 mol•L-1 CuSO4溶液2 mL和0.5 mol•L-1 NaOH溶液4 mL混合后加入40%的乙醛溶液0.5 mL,加热煮沸观察沉淀的颜色 |
6. HCOONa加热分解时,固体失重率与温度的关系如图所示,发生的反应有:
HCOONa加热分解时,固体失重率与温度的关系如图所示,发生的反应有:
2HCOONa$\frac{\underline{\;\;△\;\;}}{\;}$Na2C2O4+H2↑ ①
2HCOONa$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2↑+CO↑②
Na2C2O4$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO↑ ③
下列说法正确的是( )
 HCOONa加热分解时,固体失重率与温度的关系如图所示,发生的反应有:
HCOONa加热分解时,固体失重率与温度的关系如图所示,发生的反应有:2HCOONa$\frac{\underline{\;\;△\;\;}}{\;}$Na2C2O4+H2↑ ①
2HCOONa$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2↑+CO↑②
Na2C2O4$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO↑ ③
下列说法正确的是( )
| A. | T<415℃,只有反应①发生 | |
| B. | 反应①、②不可能同时发生 | |
| C. | 570℃<T<600℃时,残留固体的主要成分是Na2CO3 | |
| D. | 残留固体中的m(Na2C2O4)=m(Na2CO3)时,反应①、②的反应速率相等 |