题目内容
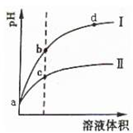 某温度下,将pH相同的盐酸和醋酸溶液分别稀释,平衡时溶液pH随溶液体积变化的曲线如图所示.据图判断下列叙述中,正确的是( )
某温度下,将pH相同的盐酸和醋酸溶液分别稀释,平衡时溶液pH随溶液体积变化的曲线如图所示.据图判断下列叙述中,正确的是( )| A、曲线Ⅰ为醋酸稀释时溶液pH变化曲线 |
| B、加入足量NaOH,b点溶液消耗的NaOH比c点溶液消耗的多 |
| C、a点时,加入少量相同大小的锌粒,与盐酸反应的速率大 |
| D、b点溶液中水的电离程度比c点溶液中水的电离程度大 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:A.氯化氢是强电解质,醋酸是弱电解质,等pH的醋酸和盐酸,醋酸的浓度大于盐酸,加水稀释促进醋酸电离,稀释相同的倍数,pH变化大的为盐酸,变化小的为醋酸;
B.酸的物质的量越大,消耗的碱越多;
C.反应速率与氢离子浓度成正比;
D.酸溶液中氢离子浓度越大,水的电离程度越小.
B.酸的物质的量越大,消耗的碱越多;
C.反应速率与氢离子浓度成正比;
D.酸溶液中氢离子浓度越大,水的电离程度越小.
解答:
解:A.pH相等的醋酸和盐酸,醋酸的浓度大于盐酸,醋酸中存在电离平衡,稀释相同的倍数,pH变化大的为盐酸,变化小的为醋酸,所以Ⅰ为盐酸,故A错误;
B.b点氢离子浓度小于c点,醋酸的浓度大于盐酸,所以等体积的两种溶液,醋酸的物质的量大于盐酸,所以醋酸消耗的氢氧化钠多,即c点消耗的氢氧化钠多,故B错误;
C.反应速率与氢离子浓度成正比,pH相等的两种酸中,氢离子浓度相等,所以开始时反应速率相等,故C错误;
D.酸溶液中氢离子浓度越大,水的电离程度越小,b点溶液酸性小于c点,所以b点溶液中水的电离程度比c点溶液中水的电离程度大,故D正确;
故选:D.
B.b点氢离子浓度小于c点,醋酸的浓度大于盐酸,所以等体积的两种溶液,醋酸的物质的量大于盐酸,所以醋酸消耗的氢氧化钠多,即c点消耗的氢氧化钠多,故B错误;
C.反应速率与氢离子浓度成正比,pH相等的两种酸中,氢离子浓度相等,所以开始时反应速率相等,故C错误;
D.酸溶液中氢离子浓度越大,水的电离程度越小,b点溶液酸性小于c点,所以b点溶液中水的电离程度比c点溶液中水的电离程度大,故D正确;
故选:D.
点评:本题考查了弱电解质的电离,根据弱电解质电离特点及反应速率与离子浓度的关系即可解答,难度中等.

练习册系列答案
相关题目
下列溶液中各微粒的浓度关系正确的是( )
| A、物质的量浓度相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中c(NH4+):c(NH4)2SO4>c(NH4HSO4)>c(NH4C1) |
| B、向醋酸钠溶液中加入适量醋酸,得到酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| C、pH=6的纯水:c(H+)>c(OH-) |
| D、1.0mol/LNa2CO3溶液:c(OH-)=c(H+)+c(H2CO3)+c(HCO3-) |
表示下列反应的离子方程式,正确的是( )
A、碳酸钠的水解反应:CO
| ||
| B、稀硝酸和过量的铁屑反应:Fe+4H++NO3═Fe3++NO↑+2H2O | ||
C、向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO
| ||
D、碳酸氢钙溶液中加入少量的氢氧化钠溶液:Ca2++HCO
|
用惰性电极电解50ml锰酸钾溶液:K2MnO4+H2O
KMnO4+H2↑+KOH(未配平),当生成112ml氢气(标准状况)时停止通电.下列判断正确的是( )
| 电解 |
| A、K+浓度减小 |
| B、KMnO4在阳极区生成 |
| C、阴极周围溶液的pH值减小 |
| D、反应过程中共转移0.005mol电子 |
在一定条件下,将3mol A和1mol B两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?xC(g)+2D(g).2min末该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol?L-1.下列判断错误的是( )
| A、x=1 |
| B、2min内A的反应速率为0.3 mol?(L?min)-1 |
| C、B的转化率为40% |
| D、若混合气体的密度不变则表明该反应达到平衡状态 |
下列反应的离子方程式正确的是( )
| A、碳酸氢镁与足量氢氧化钠溶液的反应:Mg2++2HCO3-+20H-═MgC03↓+C032-+2H20 |
| B、向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-→CH2BrC00-+H20 |
| C、硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:Fe2++2H++H202═Fe3++2H20 |
| D、淀粉碘化钾溶液在空气中变蓝:4I-+02+2H2O═2I2+40H- |
 某小组为研究电化学原理,设计如图装置.下列叙述不正确的是( )
某小组为研究电化学原理,设计如图装置.下列叙述不正确的是( )| A、a和b不连接时,铁片上会有金属铜析出 |
| B、a和b用导线连接时,铜片上发生的反应为Cu2++2e-═Cu |
| C、无论a和b是否连接,铁片均会溶解 |
| D、a和b连接时Cu2+向铁电极移动 |