题目内容
用惰性电极电解50ml锰酸钾溶液:K2MnO4+H2O
KMnO4+H2↑+KOH(未配平),当生成112ml氢气(标准状况)时停止通电.下列判断正确的是( )
| 电解 |
| A、K+浓度减小 |
| B、KMnO4在阳极区生成 |
| C、阴极周围溶液的pH值减小 |
| D、反应过程中共转移0.005mol电子 |
考点:电解原理
专题:电化学专题
分析:用惰性电极电解锰酸钾溶液时,阳极上锰酸根离子失电子发生氧化反应,阴极上氢离子放电生成氢气,结合氢气和转移电子之间的关系式计算.
解答:
解:A.电解锰酸钾溶液时,钾离子的物质的量不变,水参加反应导致溶液的体积减小,所以钾离子浓度增大,故A错误;
B.阳极上,锰酸钾离子失电子发生氧化反应而生成高锰酸根离子,所以高锰酸钾在阳极区生成,故B正确;
C.阴极上氢离子放电生成氢气,同时阴极附近生成氢氧根离子,则氢氧根离子浓度增大,溶液的pH增大,故C错误;
D.当生成112ml氢气时转移电子的物质的量=
×2×(1-0)=0.01mol,故D错误;
故选B.
B.阳极上,锰酸钾离子失电子发生氧化反应而生成高锰酸根离子,所以高锰酸钾在阳极区生成,故B正确;
C.阴极上氢离子放电生成氢气,同时阴极附近生成氢氧根离子,则氢氧根离子浓度增大,溶液的pH增大,故C错误;
D.当生成112ml氢气时转移电子的物质的量=
| 0.112L |
| 22.4L/mol |
故选B.
点评:本题考查了电解原理,明确阴阳极上发生的电极反应是解本题关键,易错选项是A,注意虽然钾离子物质的量不变,但溶液体积变化导致钾离子浓度变化,为易错点.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
下列化学用语正确的是( )
| A、氮气的结构式:N-N | ||
B、含有126个中子的铋原子:
| ||
C、过氧化钠电子式: | ||
D、氦原子核外电子的运动状态: |
用NA表示阿伏加德罗常数的数值,下列说法中一定正确的是( )
| A、1 L 1 mol?L-1的FeCl3溶液中含有NA个Fe3+ |
| B、往某容器中投入1molN2和3molH2,一定条件下充分反应后,生成的NH3的数目为2NA |
| C、钠与水反应生成1.12LH2,反应中转移的电子数为0.1NA |
| D、常温常压下,22g氧气和26g臭氧混合气体所含氧原子总数为3NA |
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A、5.6g铁与足量盐酸反应转移的电子数为0.3NA |
| B、20g重水(2H2O)中含有的中子数为10NA |
| C、0.05molC8H18分子中所含共价键数为1.5 NA |
| D、室温下,28.0g乙烯和丙烯中混合气体中含有的碳原子数为2NA |
设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
| A、1mol Cl2参加化学反应获得的电子数都是2NA |
| B、1mol CnH2n+2含有(3n+1)NA个共价键 |
| C、标准状况下,11.2L NO与11.2L O2混合后所含原子数为2NA |
| D、电解精炼铜时,电解池中每转移1mol电子,阳极上溶解的铜原子数为0.5NA |
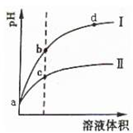 某温度下,将pH相同的盐酸和醋酸溶液分别稀释,平衡时溶液pH随溶液体积变化的曲线如图所示.据图判断下列叙述中,正确的是( )
某温度下,将pH相同的盐酸和醋酸溶液分别稀释,平衡时溶液pH随溶液体积变化的曲线如图所示.据图判断下列叙述中,正确的是( )| A、曲线Ⅰ为醋酸稀释时溶液pH变化曲线 |
| B、加入足量NaOH,b点溶液消耗的NaOH比c点溶液消耗的多 |
| C、a点时,加入少量相同大小的锌粒,与盐酸反应的速率大 |
| D、b点溶液中水的电离程度比c点溶液中水的电离程度大 |
下列实验操作或结论正确的是( )
| A、配制溶液的操作中,转移溶液后,玻璃棒、烧杯未洗涤会使得所配溶液浓度偏高 |
| B、洗涤沉淀的操作是将沉淀置于过滤器中,边用玻璃棒搅拌边加蒸馏水冲洗 |
| C、实验室配制950 mL 0.2 mol/L的CuSO4溶液时,需称取胆矾质量为50.0 g |
| D、制备Fe(OH)3胶体时,将饱和的FeCl3溶液滴入沸水中,边加热边搅拌,直到得到红褐色溶液 |
用NaOH固体,配制240mL 0.5mol/LNaOH溶液,在下列仪器中正确的是( )
①托盘天平、②量筒、③烧杯、④玻璃棒、⑤漏斗、⑥240mL容量瓶、⑦药匙、⑧250mL容量瓶、⑨胶头滴管、⑩坩埚.
①托盘天平、②量筒、③烧杯、④玻璃棒、⑤漏斗、⑥240mL容量瓶、⑦药匙、⑧250mL容量瓶、⑨胶头滴管、⑩坩埚.
| A、①③④⑥⑨⑩ |
| B、①④⑦⑧⑨⑩ |
| C、①③④⑦⑧⑨ |
| D、①②④⑤⑧⑨ |