题目内容
表示下列反应的离子方程式,正确的是( )
A、碳酸钠的水解反应:CO
| ||
| B、稀硝酸和过量的铁屑反应:Fe+4H++NO3═Fe3++NO↑+2H2O | ||
C、向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO
| ||
D、碳酸氢钙溶液中加入少量的氢氧化钠溶液:Ca2++HCO
|
考点:离子方程式的书写
专题:离子反应专题
分析:A、碳酸钠的水解分步进行,主要以第一步为主;
B、根据铁过量,生成的亚铁离子分析;
C、二氧化碳过量,生成的产物为碳酸氢根离子,不是碳酸根离子;
D、氢氧化钠少量,生成的碳酸根离子完全变成了碳酸钙沉淀.
B、根据铁过量,生成的亚铁离子分析;
C、二氧化碳过量,生成的产物为碳酸氢根离子,不是碳酸根离子;
D、氢氧化钠少量,生成的碳酸根离子完全变成了碳酸钙沉淀.
解答:
解:A、碳酸钠溶液中,碳酸根离子水解,溶液显示碱性,水解以第一步为主,离子方程式为:CO32-+H2O?HCO3-+OH-,故A错误;
B、由于铁过量,稀硝酸与铁反应生成是亚铁离子,正确的离子方程式为:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O,故B错误;
C、向NaAlO2溶液中通入过量CO2,反应生成了氢氧化铝沉淀和碳酸氢钠,离子方程式为:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,故C错误;
D、碳酸氢钙溶液中加入少量的氢氧化钠溶液,氢氧化钠不足,反应的离子方程式为:Ca2++HCO3-+OH-═CaCO3↓+H2O,故D正确;
故选:D.
B、由于铁过量,稀硝酸与铁反应生成是亚铁离子,正确的离子方程式为:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O,故B错误;
C、向NaAlO2溶液中通入过量CO2,反应生成了氢氧化铝沉淀和碳酸氢钠,离子方程式为:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,故C错误;
D、碳酸氢钙溶液中加入少量的氢氧化钠溶液,氢氧化钠不足,反应的离子方程式为:Ca2++HCO3-+OH-═CaCO3↓+H2O,故D正确;
故选:D.
点评:本题考查了离子积方程式的书写判断,注意碳酸根离子的水解分步进行,以第一步为主;离子方程式的书写是高考不变的一个题型,每年高考必考,是热点题型,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
设NA表示阿伏加德罗常数的值.下列说法中正确的是( )
| A、5.6 g Fe和一定量的浓HNO3或稀硝酸完全反应,转移电子均为0.3 NA | ||
| B、16 g氧气或臭氧的氧原子个数均为NA | ||
| C、标准状况下的4.48L的乙烯或己烷所含的分子数均为0.2NA | ||
D、28.6 g Na2CO3?10H2O在晶体中或溶液中,含有的CO
|
下列化学用语正确的是( )
A、CO2的比例模型为 | ||
B、质子数为53、中子数为72的碘原子为
| ||
| C、乙烯的结构式为CH2=CH2 | ||
| D、KHCO3的电离方程式为KHCO3═K++H++CO32- |
下列关于阿伏加德罗常数NA的说法正确的是( )
| A、铜与热的浓H2SO4反应放出1 mol气体时转移的电子数为2NA |
| B、1mol冰中含有的氢键数目为NA |
| C、标准状况下,22.4 L CCl4含有的分子数为NA |
| D、1 mol羟基含有的电子数为7NA |
用NA表示阿伏加德罗常数的数值,下列说法中一定正确的是( )
| A、1 L 1 mol?L-1的FeCl3溶液中含有NA个Fe3+ |
| B、往某容器中投入1molN2和3molH2,一定条件下充分反应后,生成的NH3的数目为2NA |
| C、钠与水反应生成1.12LH2,反应中转移的电子数为0.1NA |
| D、常温常压下,22g氧气和26g臭氧混合气体所含氧原子总数为3NA |
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A、5.6g铁与足量盐酸反应转移的电子数为0.3NA |
| B、20g重水(2H2O)中含有的中子数为10NA |
| C、0.05molC8H18分子中所含共价键数为1.5 NA |
| D、室温下,28.0g乙烯和丙烯中混合气体中含有的碳原子数为2NA |
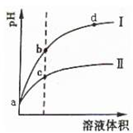 某温度下,将pH相同的盐酸和醋酸溶液分别稀释,平衡时溶液pH随溶液体积变化的曲线如图所示.据图判断下列叙述中,正确的是( )
某温度下,将pH相同的盐酸和醋酸溶液分别稀释,平衡时溶液pH随溶液体积变化的曲线如图所示.据图判断下列叙述中,正确的是( )| A、曲线Ⅰ为醋酸稀释时溶液pH变化曲线 |
| B、加入足量NaOH,b点溶液消耗的NaOH比c点溶液消耗的多 |
| C、a点时,加入少量相同大小的锌粒,与盐酸反应的速率大 |
| D、b点溶液中水的电离程度比c点溶液中水的电离程度大 |
 有A、B、C、D四种物质,如图所示,A、B、C在一定下可以发生转化,在C溶液中通入CO2,溶液变浑浊,生成白色沉淀A.D与A、B、C均能发生反应,D与C发生中和反应,D与A反应有CO2气体产生,D与AgNO3溶液反应,可产生不溶于稀硝酸的白色沉淀.
有A、B、C、D四种物质,如图所示,A、B、C在一定下可以发生转化,在C溶液中通入CO2,溶液变浑浊,生成白色沉淀A.D与A、B、C均能发生反应,D与C发生中和反应,D与A反应有CO2气体产生,D与AgNO3溶液反应,可产生不溶于稀硝酸的白色沉淀.