题目内容
为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏,某化学家在催化条件下,通过反应CCl4+H2?CHCl3+HCl使CCl4转化为重要的化工原料氯仿(CHCl3).已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃.在密闭容器中,该反应达到平衡后.测得如表所示数据(不考虑副反应).
(1)实验2中,10h后反应达到平衡,则H2的平均反应速率为 .
(2)实验3中,b的值 (填序号).
A.等于50% B.大于50% C.小于50% D.从题给信息无法判断
(3)根据题目所给的条件,能否求出a的值? 填(“能”或“不能”).
| 实验序号 | 温度℃ | 初始c(CCl4)(mol?L-1) | 初始c(H2)(mol?L-1) | CCl4的平衡转化率 |
| l | 110 | 0.8 | 1.2 | a |
| 2 | 110 | l | 1 | 50% |
| 3 | 100 | l | 1 | b |
(2)实验3中,b的值
A.等于50% B.大于50% C.小于50% D.从题给信息无法判断
(3)根据题目所给的条件,能否求出a的值?
考点:化学平衡的计算
专题:化学平衡专题
分析:(1)根据速率概念和不同温度下的平衡常数来判断;
(2)根据外界条件对化学平衡的影响分析反应热量变化和平衡移动来解答;
(3)依据2计算反应的平衡常数,平衡常数随温度变化,利用化学平衡三段式解释计算平衡浓度,列式计算平衡常数计算消耗的四氯化碳得到转化率.
(2)根据外界条件对化学平衡的影响分析反应热量变化和平衡移动来解答;
(3)依据2计算反应的平衡常数,平衡常数随温度变化,利用化学平衡三段式解释计算平衡浓度,列式计算平衡常数计算消耗的四氯化碳得到转化率.
解答:
解:(1)实验2中,10h后达到平衡,CCl4的转化率为50%
CCl4(g)+H2(g)?CHCl3(g)+HCl(g),
起始(mol/L ) 1 1 0 0
反应(mol/L ) 0.5 0.5 0.5 0.5
平衡(mol/L) 0.5 0.5 0.5 0.5
则H2的平均反应速率=
=0.05mol/(L?h);
故答案为:0.05mol/(L?h);
(2)CCl4+H2
CHCl3+HCl 此反应能自发进行,伴随有副反应,会生成CH2Cl2、CH3Cl和CH4等.已知CCl4的沸点为 77℃,CHCl3的沸点为 61.2℃.反应是熵增加的反应,可知△H-T?△S<0,则反应是放热反应;所以温度110℃降低到 100℃,平衡正向进行,CCl4转化率大于50%,
故选:B;
(3)依据实验2中,10h后达到平衡,CCl4的转化率为50%,列式计算得到平衡常数
CCl4(g)+H2(g)?CHCl3(g)+HCl(g),
起始(mol/L ) 1 1 0 0
反应(mol/L ) 0.5 0.5 0.5 0.5
平衡(mol/L) 0.5 0.5 0.5 0.5
则平衡常数为
=
=1;
实验1中,设四氯化碳转化的浓度为a
CCl4(g)+H2(g)?CHCl3(g)+HCl(g),
起始(mol/L ) 0.8 1.2 0 0
反应(mol/L ) a a a a
平衡(mol/L) 0.8-a 1.2-a a a
则平衡常数为
=
=1,
所以a=0.48mol/L,
则CCl4的转化率为
×100%=60%,
故答案为:能.
CCl4(g)+H2(g)?CHCl3(g)+HCl(g),
起始(mol/L ) 1 1 0 0
反应(mol/L ) 0.5 0.5 0.5 0.5
平衡(mol/L) 0.5 0.5 0.5 0.5
则H2的平均反应速率=
| 0.5mol/L |
| 10h |
故答案为:0.05mol/(L?h);
(2)CCl4+H2
| ||
| △ |
故选:B;
(3)依据实验2中,10h后达到平衡,CCl4的转化率为50%,列式计算得到平衡常数
CCl4(g)+H2(g)?CHCl3(g)+HCl(g),
起始(mol/L ) 1 1 0 0
反应(mol/L ) 0.5 0.5 0.5 0.5
平衡(mol/L) 0.5 0.5 0.5 0.5
则平衡常数为
| c(HCl)c(CHCl3) |
| c(H2)c(CCl4) |
| 0.5×0.5 |
| 0.5×0.5 |
实验1中,设四氯化碳转化的浓度为a
CCl4(g)+H2(g)?CHCl3(g)+HCl(g),
起始(mol/L ) 0.8 1.2 0 0
反应(mol/L ) a a a a
平衡(mol/L) 0.8-a 1.2-a a a
则平衡常数为
| c(HCl)c(CHCl3) |
| c(H2)c(CCl4) |
| a×a |
| (0.8-a)(1.2-a) |
所以a=0.48mol/L,
则CCl4的转化率为
| 0.48 |
| 0.8 |
故答案为:能.
点评:本题考查化学平衡的计算,侧重于化学平衡常数的概念分析和计算应用,化学平衡的三段式计算,反应速率的概念计算应用,题目难度中等.

练习册系列答案
相关题目
下列化学用语正确的是( )
A、CO2的比例模型为 | ||
B、质子数为53、中子数为72的碘原子为
| ||
| C、乙烯的结构式为CH2=CH2 | ||
| D、KHCO3的电离方程式为KHCO3═K++H++CO32- |
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A、5.6g铁与足量盐酸反应转移的电子数为0.3NA |
| B、20g重水(2H2O)中含有的中子数为10NA |
| C、0.05molC8H18分子中所含共价键数为1.5 NA |
| D、室温下,28.0g乙烯和丙烯中混合气体中含有的碳原子数为2NA |
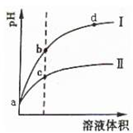 某温度下,将pH相同的盐酸和醋酸溶液分别稀释,平衡时溶液pH随溶液体积变化的曲线如图所示.据图判断下列叙述中,正确的是( )
某温度下,将pH相同的盐酸和醋酸溶液分别稀释,平衡时溶液pH随溶液体积变化的曲线如图所示.据图判断下列叙述中,正确的是( )| A、曲线Ⅰ为醋酸稀释时溶液pH变化曲线 |
| B、加入足量NaOH,b点溶液消耗的NaOH比c点溶液消耗的多 |
| C、a点时,加入少量相同大小的锌粒,与盐酸反应的速率大 |
| D、b点溶液中水的电离程度比c点溶液中水的电离程度大 |
下列实验操作或结论正确的是( )
| A、配制溶液的操作中,转移溶液后,玻璃棒、烧杯未洗涤会使得所配溶液浓度偏高 |
| B、洗涤沉淀的操作是将沉淀置于过滤器中,边用玻璃棒搅拌边加蒸馏水冲洗 |
| C、实验室配制950 mL 0.2 mol/L的CuSO4溶液时,需称取胆矾质量为50.0 g |
| D、制备Fe(OH)3胶体时,将饱和的FeCl3溶液滴入沸水中,边加热边搅拌,直到得到红褐色溶液 |
NA代表阿伏加德罗常数,下列叙述正确的是( )
| A、100 mL 1 mol?L-1的AlCl3溶液中,含有Al3+的数目为0.1NA |
| B、5.6 g Fe与足量的稀盐酸充分反应后,转移的电子数为0.3NA |
| C、标准状况下,22.4 L N2和O2的混合气体中,含原子数为NA |
| D、2.8 g乙烯与一氧化碳的混合气体中,含分子数为0.1NA |
下列说法中正确的是( )
| A、过氧化氢是由氢气和氧气组成的 |
| B、酸和碱中都一定含有氢元素和氧元素 |
| C、碱中一定含有氢氧根离子 |
| D、氧化物和盐中一定含有氧元素 |

 有A、B、C、D四种物质,如图所示,A、B、C在一定下可以发生转化,在C溶液中通入CO2,溶液变浑浊,生成白色沉淀A.D与A、B、C均能发生反应,D与C发生中和反应,D与A反应有CO2气体产生,D与AgNO3溶液反应,可产生不溶于稀硝酸的白色沉淀.
有A、B、C、D四种物质,如图所示,A、B、C在一定下可以发生转化,在C溶液中通入CO2,溶液变浑浊,生成白色沉淀A.D与A、B、C均能发生反应,D与C发生中和反应,D与A反应有CO2气体产生,D与AgNO3溶液反应,可产生不溶于稀硝酸的白色沉淀.