题目内容
19.从H+、Cu2+、Na+、SO42-、Cl-五种离子中两两恰当地组成电解质,按下列要求进行电解:(用化学式表示)(1)以碳棒为电极,使电解质质量减少,水量不变进行电解,则采用的电解质是CuCl2、HCl.
(2)以碳棒为电极,使电解质质量不变,水量减少进行电解,则采用的电解质是Na2SO4、H2SO4.
(3)以铂为电极,使电解质和水量都减少进行电解,则电解质是CuSO4、NaCl.
分析 根据电解池的工作原理阳离子放电顺序为Cu2+>H+>Na+,阴离子放电顺序为Cl->OH->SO42-;
(1)碳棒是惰性电极,当阳极上是氯离子放电、阴极上是铜离子放电或氢离子放电时,且电解质必须是可溶性的,此时电解质质量减少、水量不变;
(2)惰性电极电解可溶性强碱、强的含氧酸、可溶性含氧酸的强酸强碱盐溶液时,电解质质量不变,水量减少;
(3)Pt为惰性电极,当电解电解质和水时,阳极上OH-离子之前离子放电和H+放电或OH-放电和H+之前离子放电,且电解质必须是可溶性的.
解答 解:根据电解池的工作原理阳离子放电顺序为Cu2+>H+>Na+,阴离子放电顺序为Cl->OH->SO42-;
(1)碳棒是惰性电极,当电解CuCl2溶液或者HCl溶液时,电解质质量减小,水量不变,故答案为:CuCl2、HCl;
(2)惰性电极电解Na2SO4溶液或者H2SO4溶液时,氢离子、氢氧根离子放电,则电解质质量不变,水量减少,故答案为:Na2SO4、H2SO4;
(3)以Pt为电极,电解CuSO4、NaCl溶液时,则铜离子、氢氧根离子、氯离子、氢离子放电,所以电解质和水量都减少,故答案为:CuSO4、NaCl;
点评 本题考查电解原理以及应用知识,明确离子的放电顺序是解答本题的关键,注意电极材料与发生的电极反应即可解答,题目难度不大.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案
相关题目
9.下列是IA族的Li、Na、K三种金属元素的电离能
则三种金属的氯化物的熔点由高到低的顺序为XCl>YCl>ZCl (填化学式),原因是离子晶体熔沸点与晶格能成正比.
| X | Y | Z | |
| 第一电离能(KJ/mol) | 526.2 | 502.8 | 425.2 |
10.常温下,物质的量浓度均为0.1mol•L-1 的①Na2CO3溶液 ②CH3COONa溶液 ③NaOH溶液各25mL,下列说法正确的是( )
| A. | 3种溶液pH的大小顺序是 ③>②>① | |
| B. | 若将3种溶液稀释相同倍数,pH变化最大的是② | |
| C. | 若分别加入25mL0.1mol•L-1盐酸后,pH最大的是① | |
| D. | 若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>② |
7.下列各表述与示意图一致的是( )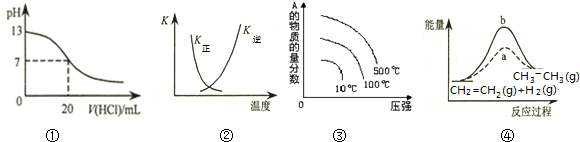

| A. | 图①表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化 | |
| B. | 图②中曲线表示反应2SO2(g)+O2(g)═2SO3(g)△H<0,正、逆反应的平衡常数K随温度的变化 | |
| C. | 对于可逆反应:A2(g)+3B2(g)?2AB3(g)△H>0,图③表示的是压强、温度、A的物质的量的分数的关系 | |
| D. | 图④中a、b曲线分别表示反应CH2=CH2 (g)+H2(g)→CH3CH3(g)△H<0,使用和未使用催化剂时,反应过程中的能量变化 |
14.下列指定反应的离子方程式正确的是( )
| A. | 氯化铝溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | NaClO溶液中通入少量SO2:3ClO-+SO2+H2O═Cl-+SO42-+2HClO | |
| C. | 向稀NH4HCO3溶液中加入过量NaOH溶液:NH4++OH-═NH3•H2O | |
| D. | 10 mL 0.5 mol•L-1的KAl(SO4)2溶液与20 mL 0.5 mol•L-1的Ba(OH)2溶液混合反应:3Ba2++6OH-+2Al3++3SO42-═3BaSO4↓+2Al(OH)3↓ |
8.下列有关金属材料的说法不正确的是( )
| A. | 铁有良好的导热性,常用来制作炊具 | |
| B. | 铜的化学性质不活泼,因此可用于制导线 | |
| C. | 废旧电池中汞的回收可减少对环境的污染 | |
| D. | 钛合金与人体有很好的“相容性,因此可用来制造人造骨 |
9.下列离子组一定能大量共存的是( )
| A. | 甲基橙呈红色的溶液中:Fe2+、Cl-、NO3-、Na+ | |
| B. | 石蕊呈蓝色的溶液中:K+、AlO2-、SiO32-、HSO3- | |
| C. | 含大量Al3+的溶液中:K+、Ca2+、NO3-、HCO3- | |
| D. | 含大量OH一的溶液中:CO32-、ClO3-、F-、K+ |