题目内容
4.某同学利用如图1所示的实验装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质.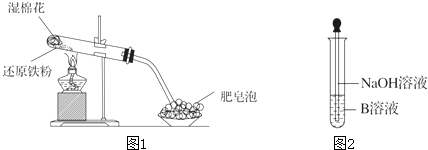
请回答下列问题:
(1)硬质试管中发生反应的化学方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4 +4H2.
(2)该同学欲确定反应后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色则说明硬质试管中固体物质的成分一定有Fe3O4,可能有Fe,若溶液未变红色则说明硬质试管中固体物质的成分是Fe3O4和Fe.
(3)该同学按上述实验方案进行了实验,结果溶液未变红色,原因是:Fe+2Fe3+=3Fe2+(用离子方程式表示).
(4)该同学马上另取少量溶液B,使其跟NaOH溶液反应.若按图2所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出上述白色沉淀变成红褐色的化学方程式:4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(5)一段时间后,该同学发现(3)中未变红的溶液变成红色,说明Fe2+具有还原性.
分析 铁和水蒸气在高温条件下反应生成四氧化三铁和氢气,但也要考虑到可能会有反应不完全的铁粉,所以将所得固体溶于酸后加入硫氰化钾,不一定变红;氢氧化亚铁生成后,容易被氧气氧化为氢氧化铁;为了获得持久白色的Fe(OH)2沉淀,必须通过蒸馏水煮沸、排除装置中的空气等办法使得氢氧化亚铁生成在一个无氧的环境中,
(1)铁粉与水蒸气反应产物为四氧化三铁和氢气;
(2)产物四氧化三铁中有+2价的铁和+3价的铁,还有可能有过量的铁;过量的铁,可能将三价铁离子全部转化成二价铁离子;
(3)Fe2+与KSCN溶液不反应;
(4)白色沉淀为氢氧化亚铁,红褐色沉淀为氢氧化铁,据此写出相应的化学反应方程式;
(5)Fe2+易被空气中的氧气氧化,具有还原性;
解答 解:(1)铁跟水蒸气在高温条件下发生反应:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4 +4H2,
故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4 +4H2;
(2)反应后硬质试管中固体物质一定有Fe3O4,还可能有没反应完全的铁粉,取少许其中的固体物质溶于稀硫酸后,滴加KSCN溶液,若溶液变红色则说明硬质试管中固体物质的成分一定含Fe3O4,可能有Fe;若溶液未变红色,是因为固体物质中既含Fe3O4又含Fe,溶于盐酸后发生反应Fe+2Fe3+═2Fe2+,导致Fe3+被还原,溶液才未变红色,
故答案为:Fe3O4;Fe;Fe3O4和Fe;
(3)结果溶液未变红色,原因是加入稀硫酸时发生反应:Fe+2Fe3+=3Fe2+,
故答案为:Fe+2Fe3+=3Fe2+;
(4)溶液B中含Fe2+,滴入NaOH溶液后,发生反应:FeSO4+2NaOH=Fe(OH)2↓+Na2SO4,生成Fe(OH)2是白色沉淀.沉淀迅速变成灰绿色,最后变成红褐色,是典型的Fe(OH)2被氧化为Fe(OH)3的现象,反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(5)一段时间后,该同学发现(3)中未变红的溶液变成红色,是因为空气中的氧气将Fe2+氧化为了Fe3+的原因,在此反应中Fe2+被氧化,体现还原性,
故答案为:还原.
点评 本题主要考查了铁与水蒸气的反应以及产物的分析判断,考查了氢氧化亚铁的制备,掌握基础知识是解答的关键,本题难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案①甲苯 ②乙酸 ③乙醇 ④乙酸乙酯 ⑤油脂.
| A. | ①③⑤ | B. | ②③④ | C. | ②③⑤ | D. | ②④⑤ |
| A. | 棉花和蚕丝的主要成分都是纤维素 | |
| B. | 淀粉和蛋白质在一定条件下都能发生水解反应生成葡萄糖 | |
| C. | 食用植物油的主要成分是不饱和高级脂肪酸甘油酯,属于高分子化合物 | |
| D. | 由青蒿素(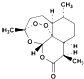 )合成双氢青蒿素( )合成双氢青蒿素(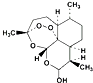 )的反应属于加成反应 )的反应属于加成反应 |
| A. | 钢铁水闸可用牺牲阳极或外加电流的阴极保护法防止其腐蚀 | |
| B. | 室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,溶液pH>7 | |
| C. | 若H2O2分解产生1molO2,理论上转移的电子数约为4×6.02×1023 | |
| D. | 一定条件下反应N2+3H2?2NH3达到平衡时,3v正(H2)=2v逆(NH3) |

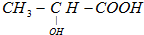 ),乳酸在微生物作用下分解为CO2和H2O.
),乳酸在微生物作用下分解为CO2和H2O.


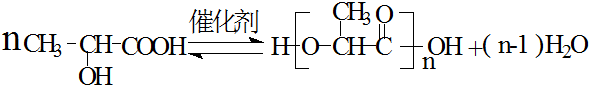 .
.