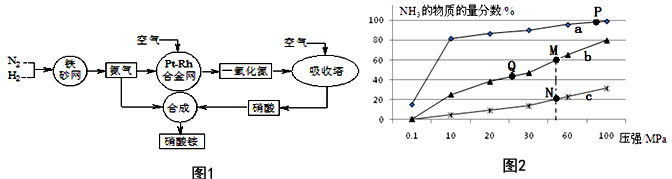
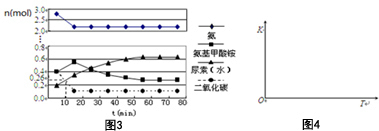
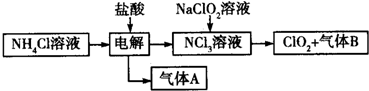
题目内容
9.下列离子组一定能大量共存的是( )| A. | 甲基橙呈红色的溶液中:Fe2+、Cl-、NO3-、Na+ | |
| B. | 石蕊呈蓝色的溶液中:K+、AlO2-、SiO32-、HSO3- | |
| C. | 含大量Al3+的溶液中:K+、Ca2+、NO3-、HCO3- | |
| D. | 含大量OH一的溶液中:CO32-、ClO3-、F-、K+ |
分析 A.甲基橙呈红色的溶液为酸性溶液,硝酸根离子在酸性条件下能够氧化亚铁离子;
B.石蕊呈蓝色的溶液中存在大量氢氧根离子,亚硫酸氢根离子与氢氧根离子、硅酸根离子反应、偏铝酸根离子反应;
C.铝离子与碳酸氢根离子发生双水解反应;
D.四种离子之间不反应,都不与氢氧根离子反应.
解答 解:A.甲基橙呈红色的溶液为酸性溶液,Fe2+、NO3-在酸性条件下发生氧化还原反应,在溶液中不能大量共存,故A错误;
B.石蕊呈蓝色的溶液为碱性溶液,溶液中存在大量氢氧根离子,OH-、AlO2-、SiO32-与HSO3-反应,在溶液中不能大量共存,故B错误;
C.Al3+、HCO3-之间发生双水解反应生成氢氧化铝沉淀和二氧化碳气体,在溶液中不能大量共存,故C错误;
D.CO32-、ClO3-、F-、K+之间不发生反应,都不与OH-反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查了离子共存,题目难度中等,明确离子反应发生条件为解答关键,注意掌握题干暗含条件的含义,试题培养了学生的分析、理解能力及灵活运用能力.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案
相关题目
20.将NaHCO3和Na2O2的固体混合物x g在密闭容器中加热至250℃,充分反应后排出气体.将反应后的固体溶入水无气体放出,再逐滴加入盐酸,产生气体(标准状况)与所加盐酸体积之间的关系如图所示.下列说法错误的是( )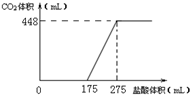

| A. | HCl的浓度0.2mol/L | |
| B. | 反应后固体的成分为NaOH与Na2CO3 | |
| C. | 密闭容器中排出气体的成分为O2和H2O | |
| D. | x的数值为6.09 |
17.以0.10mol/L的氢氧化钠溶液滴定某一元酸HA的滴定曲线如图所示.下列表述正确的是( )
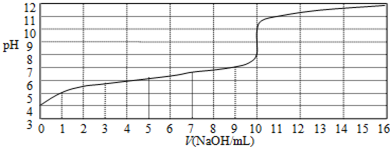

| A. | 此实验可以选用甲基橙作指示剂 | |
| B. | 该酸HA的浓度约为1×10-4mol/L | |
| C. | 当NaOH体积为9 mL时,恰好完全中和反应 | |
| D. | 达到滴定终点时,溶液中c(Na+)>c (A-) |
15.用甲烷和二氧化碳可以制备化工原料.
(1)一定温度下,向容积恒定为2L的密闭容器中通人3molCO2、3molCH4,发生如下反应:
CO2(g)+CH4 (g)?2CO (g)+2H2(g)
反应在2min末达到平衡状态,此时测得CO2和CO的体积分数相等.请回答下列问题:
①2min内,用H2来表示的反应速率v(H2)=0.5mol/(L.min);
②此温度下该反应的平衡常数K=1;
③下列叙述可以作为该反应达到平衡状态的标志的是BC;(填选项字母)
A.v正(CH4)=2v 逆(H2) B.容器内压强保持恒定不变
C.反应中断裂2mol C一H键同时消耗lmolH2 D.容器内混合气体的密度保持恒定不变
④已知:
则反应CO2(g)+CH4(g)?2CO (g)+2H2(g)△H=+248kJ/mol.
⑤为提高CH4的转化率,可以采取的措施是减小反应压强、增大CO2的浓度(写两点).
(2)在催化作用下,甲烷和二氧化碳还可以直接转化成乙酸.
①在不同温度下乙酸的生成速率如图所示:
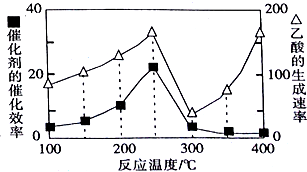
在250~400℃范围内,乙酸的生成速率随温度变化的原因是温度超过250℃时,温度升高催化剂的催化效率降低,250~300℃之间催化剂为影响反应速率主要因素,乙酸的生成速率降低,而温度高于300℃后,温度是影响反应速率主要因素,乙酸的生成速率随温度升高而升高.
②250℃与400℃时乙酸的生成速率相近,请分析判断实际生产选择的最佳温度是250℃.
(1)一定温度下,向容积恒定为2L的密闭容器中通人3molCO2、3molCH4,发生如下反应:
CO2(g)+CH4 (g)?2CO (g)+2H2(g)
反应在2min末达到平衡状态,此时测得CO2和CO的体积分数相等.请回答下列问题:
①2min内,用H2来表示的反应速率v(H2)=0.5mol/(L.min);
②此温度下该反应的平衡常数K=1;
③下列叙述可以作为该反应达到平衡状态的标志的是BC;(填选项字母)
A.v正(CH4)=2v 逆(H2) B.容器内压强保持恒定不变
C.反应中断裂2mol C一H键同时消耗lmolH2 D.容器内混合气体的密度保持恒定不变
④已知:
| 物质 | H2 | CO | CH4 | CH3COOH |
| 燃烧热(kJ/mol) | 286 | 283 | 890 | 874 |
⑤为提高CH4的转化率,可以采取的措施是减小反应压强、增大CO2的浓度(写两点).
(2)在催化作用下,甲烷和二氧化碳还可以直接转化成乙酸.
①在不同温度下乙酸的生成速率如图所示:

在250~400℃范围内,乙酸的生成速率随温度变化的原因是温度超过250℃时,温度升高催化剂的催化效率降低,250~300℃之间催化剂为影响反应速率主要因素,乙酸的生成速率降低,而温度高于300℃后,温度是影响反应速率主要因素,乙酸的生成速率随温度升高而升高.
②250℃与400℃时乙酸的生成速率相近,请分析判断实际生产选择的最佳温度是250℃.