题目内容
6.以电石渣为原料制备KClO3的流程如图1: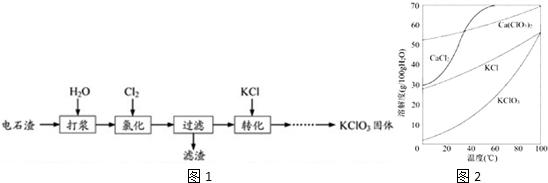
(1)氯化过程控制电石渣过量,在75℃左右进行.氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2,少量Ca(ClO)2分解为CaCl2和O2.
①生成Ca(ClO)2的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.
②提高Cl2转化为Ca(ClO3)2的转化率的可行措施有AB(填序号).
A.适当减缓通入Cl2速率 B.充分搅拌浆料 C.加水使Ca(OH)2完全溶解
(2)氯化过程中Cl2转化为Ca(ClO3)2的总反应方程式为6Ca(OH)2+6Cl2═Ca(ClO3)2+5CaCl2+6H2O
氯化完成后过滤.
①滤渣的主要成分为CaCO3、Ca(OH)2(填化学式).
②滤液中Ca(ClO3)2与CaCl2物质的量之比<n:n1:5(填“>”、“<”或“=”)
(3)向滤液中加入稍过量KCl固体可将Ca(ClO3)2转化为KClO3,若溶液中KClO3的含量为100g?L-1,从该溶液中尽可能多地析出KClO3固体的方法是蒸发浓缩、冷却结晶.
分析 电石渣含有Ca(OH)2,加入水打浆,通入氯气,可生成Ca(ClO)2,Ca(ClO)2进一步转化为Ca(ClO3)2,过滤后在滤液中加入KCl转化生成KClO3,经蒸发浓缩、冷却结晶可得晶体KClO3,
(1)①氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水;
②提高Cl2转化为Ca(ClO3)2的转化率,可使氯气和氢氧化钙充分接触;
(2)①发生6Ca(OH)2+6Cl2═Ca(ClO3)2+5CaCl2+6H2O,生成的Ca(ClO3)2溶于水,CaCO3不溶于水,Ca(OH)2微溶;
②氯化过程中Cl2与氢氧化钙反应部分生成Ca(ClO)2和CaCl2;
(3)经蒸发浓缩、冷却结晶可得晶体KClO3.
解答 解:电石渣含有Ca(OH)2,加入水打浆,通入氯气,可生成Ca(ClO)2,Ca(ClO)2进一步转化为Ca(ClO3)2,过滤后在滤液中加入KCl转化生成KClO3,经蒸发浓缩、冷却结晶可得晶体KClO3,
(1)②氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,反应的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
②提高Cl2转化为Ca(ClO3)2的转化率,可使氯气和氢氧化钙充分接触,可适当减缓通入Cl2速率、充分搅拌浆料,因氢氧化钙微溶于水,加水溶解的做法不可取,因浓度过低,对后续实验不利,
故答案为:AB;
(2)①发生6Ca(OH)2+6Cl2═Ca(ClO3)2+5CaCl2+6H2O,生成的Ca(ClO3)2溶于水,CaCO3不溶于水,Ca(OH)2微溶,则滤渣中含有CaCO3、Ca(OH)2,
故答案为:CaCO3、Ca(OH)2;
②氯化过程中Cl2与氢氧化钙反应部分生成Ca(ClO)2和CaCl2,则n[Ca(ClO3)2]:n[CaCl2]<1:5,故答案为:<;
(3)该溶液中尽可能多地析出KClO3固体,应经蒸发浓缩、冷却结晶,故答案为:蒸发浓缩、冷却结晶.
点评 本题考查物质的制备,为高考常见题型和高频考点,侧重于学生的分析、实验能力的考查,解答本题注意把握物质的性质以及题给信息,把握反应的流程,同时要具有扎实的实验基础知识,难度不大.

 名校课堂系列答案
名校课堂系列答案
(1)提出假设:
猜测1:白色不溶物可能为Mg(OH)2.
猜测2:白色不溶物可能为MgCO3猜测3:白色不溶物可能为碱式碳酸镁[yMg(OH)2•xMgCO3]
(2)定性实验:
| 实验序号 | 实验 | 实验现象 | 结论 |
| 实验Ⅰ | 取一小段镁条,用砂纸擦去表面氧化膜,将其放入足量的滴有酚酞的饱和NaHCO3溶液中,充分反应后过滤 | 产生较多气泡和白色不溶物,溶液有浅红色变成红色 | |
| 实验Ⅱ | 将实验Ⅰ中收集到的气体点燃 | 能安静燃烧,火焰呈淡蓝色 | 气体成分为 ①氢气 |
| 实验Ⅲ | 取实验Ⅰ中白色不溶物滤出、洗涤,取少量加入足量稀盐酸 | ②产生气泡沉淀全部溶解 | 白色不溶物中含有 MgCO3 |
| 实验Ⅳ | ③CaCl2或BaCl2 | 产生白色沉淀,溶液红色变浅 | 溶液中存在CO32- |
(3)定量实验:
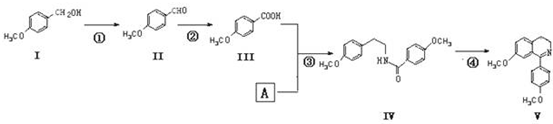
称取干燥、纯净的白色不溶物 14.2g,充分加热至不再产生气体为止,并使分解产生的气体全部进入如图装置中.实验后装置A 增重1.8g,装置B 增重4.4g.装置C 的作用是;若移除装置C 会导致x/y 的值偏大.
(填“偏大”、“偏小”或“不变”).?写出镁与饱和碳酸氢钠溶液反应的化学方程式3Mg+4NaHCO3+2H2O=Mg(OH)2•2MgCO3↓+2Na2CO3+3H2↑.
 .
. .
.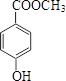 (或
(或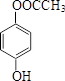 、
、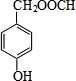 ).
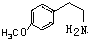
).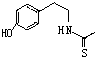 )在一定条件下也能发生类似上述第④步骤的环化反应,化合物Ⅶ环化反应产物的结构简式为
)在一定条件下也能发生类似上述第④步骤的环化反应,化合物Ⅶ环化反应产物的结构简式为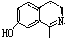 .
.
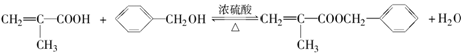 .
.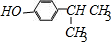 .
. (1)有两种气体单质Am和Bn.已知7.2g Am和6.3g Bn所含的原子个数相同,分子个数之比却为2:3.又知A原子中L电子层含电子数是K电子层的3倍.通过计算回答:写出B的元素名称氮
(1)有两种气体单质Am和Bn.已知7.2g Am和6.3g Bn所含的原子个数相同,分子个数之比却为2:3.又知A原子中L电子层含电子数是K电子层的3倍.通过计算回答:写出B的元素名称氮