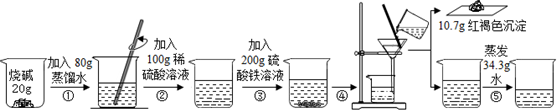
题目内容
18.资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物.某同学通过如图实验探究反应原理并验证产物. 实验I:用砂纸擦去镁条表面氧化膜,将其放入盛适量滴有酚酞的饱和碳酸氢钠溶液的烧杯中,迅速反应,产生大量气泡和白色不溶物,溶液的浅红色加深.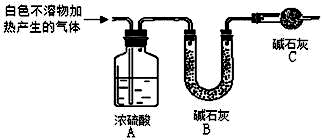
(1)提出假设:
猜测1:白色不溶物可能为Mg(OH)2.
猜测2:白色不溶物可能为MgCO3猜测3:白色不溶物可能为碱式碳酸镁[yMg(OH)2•xMgCO3]
(2)定性实验:
| 实验序号 | 实验 | 实验现象 | 结论 |
| 实验Ⅰ | 取一小段镁条,用砂纸擦去表面氧化膜,将其放入足量的滴有酚酞的饱和NaHCO3溶液中,充分反应后过滤 | 产生较多气泡和白色不溶物,溶液有浅红色变成红色 | |
| 实验Ⅱ | 将实验Ⅰ中收集到的气体点燃 | 能安静燃烧,火焰呈淡蓝色 | 气体成分为 ①氢气 |
| 实验Ⅲ | 取实验Ⅰ中白色不溶物滤出、洗涤,取少量加入足量稀盐酸 | ②产生气泡沉淀全部溶解 | 白色不溶物中含有 MgCO3 |
| 实验Ⅳ | ③CaCl2或BaCl2 | 产生白色沉淀,溶液红色变浅 | 溶液中存在CO32- |
(3)定量实验:
称取干燥、纯净的白色不溶物 14.2g,充分加热至不再产生气体为止,并使分解产生的气体全部进入如图装置中.实验后装置A 增重1.8g,装置B 增重4.4g.装置C 的作用是;若移除装置C 会导致x/y 的值偏大.
(填“偏大”、“偏小”或“不变”).?写出镁与饱和碳酸氢钠溶液反应的化学方程式3Mg+4NaHCO3+2H2O=Mg(OH)2•2MgCO3↓+2Na2CO3+3H2↑.
分析 (1)依据猜测可知白色不溶物可能是Mg(OH)2 或MgCO3或Mg(OH)2 ,MgCO3;
(2)依据实验Ⅱ的现象分析,镁条和碳酸氢钠溶液迅速反应,产生大量气泡和白色不溶物,可以说明镁与饱和碳酸氢钠溶液反应能生成一种无色气体和一种白色不溶物;气体安静燃烧、产生淡蓝色火焰,说明该气体具有可燃性,再根据质量守恒定律反应前后元素种类不变分析出是氢气;
依据实验Ⅲ的推断分析,加入一种试剂产生气泡可知碳酸盐与酸反应产生二氧化碳,所以加入的是酸,有气泡产生,说明含有碳酸镁;加入盐酸沉淀碳酸镁全部溶解;
依据实验Ⅳ加入氯化钙生成沉淀证明含有碳酸根离子;
实验Ⅲ中洗涤的操作方法是用玻璃棒引流,向过滤器(或漏斗)中注入蒸馏水至浸没沉淀,等水自然流尽后,重复2~3遍;
(3)根据B中碱石灰质量的增加量就是生成的二氧化碳的质量,所以B不能直接与空气接触,为了防止空气中的水蒸气和CO2进入装置B中,影响实验结果,所以应连接一个干燥装置除去空气中的水蒸气和CO2;根据B中碱石灰质量的增加量就是生成的二氧化碳的质量计算出碳酸镁的质量,剩余的就是氢氧化镁的质量,根据分析、计算出白色固体的组成,再根据元素守恒写出反应的化学方程式.
解答 解:(1)依据猜测可知白色不溶物可能是Mg(OH)2 或MgCO3或Mg(OH)2 ,MgCO3,故答案为:Mg(OH)2 ;
(2)①迅速反应,产生大量气泡和白色不溶物,可以说明镁与饱和碳酸氢钠溶液反应能生成一种无色气体和一种白色不溶物,气体安静燃烧、产生淡蓝色火焰,说明该气体具有可燃性,再根据质量守恒定律反应前后元素种类不变,该气体可能是氢气或一氧化碳,如果测定是一氧化碳时,燃烧后需要用到澄清石灰水,所以该气体是氢气;
②依据实验Ⅲ的推断分析,加入一种试剂产生气泡可知碳酸盐与酸反应产生二氧化碳,所以加入的是酸,有气泡产生,说明含有碳酸镁,加入盐酸沉淀碳酸镁全部溶解;
③依据实验Ⅳ加入CaCl2或BaCl2生成沉淀证明含有碳酸根离子,
④实验Ⅲ中洗涤的操作方法是用玻璃棒引流,向过滤器(或漏斗)中注入蒸馏水至浸没沉淀,等水自然流尽后,重复2~3遍;
故答案为:①氢气;②产生气泡沉淀全部溶解;③CaCl2或BaCl2;④用玻璃棒引流,向过滤器(或漏斗)中注入蒸馏水至浸没沉淀,等水自然流尽后,重复2~3遍;
(3)根据B中碱石灰质量的增加量就是生成的二氧化碳的质量,所以B不能直接与空气接触,为了防止空气中的水蒸气和CO2进入装置B中,影响实验结果,所以应连接一个干燥装置除去空气中的水蒸气和CO2;如果不用C装置,则测得的二氧化碳的质量偏大,也就会导致x/y 的值偏大,
B中碱石灰质量的增加量就是生成的二氧化碳的质量,所以生成二氧化碳的质量为8.8g,设生成8.8g二氧化碳,需要碳酸镁的质量为X则:
MgCO3+2HCl═MgCl2+H2O+CO2↑
84 44
X 8.8g
根据:$\frac{84}{44}$=$\frac{x}{8.8}$
解得X=16.8g,所以含有氢氧化镁质量为:22.6g-16.8g=5.8g;
碳酸镁和氢氧化镁物质的量之比为:$\frac{16.8g}{84g/mol}$:$\frac{5.8g}{58g/mol}$=0.2:0.1=2:1,白色不溶物的化学式为Mg(OH)2(CO3)2或2MgCO3•Mg(OH)2,
所以镁与饱和碳酸氢钠溶液反应生成2Mg(OH)2•2MgCO3沉淀、Na2CO3和H2,反应的化学方程式为:3Mg+4NaHCO3+2H2O=Mg(OH)2•2MgCO3↓+2Na2CO3+3H2↑,
故答案为:防止空气中的水蒸气和CO2进入装置B中,影响实验结果;偏大;3Mg+4NaHCO3+2H2O=Mg(OH)2•2MgCO3↓+2Na2CO3+3H2↑.
点评 本题考查全面,从定性和定量两个方面测定物质的种类,关键在于知道碳酸根离子与酸反应能产生二氧化碳,镁和氢离子反应生成氢气,题目难度较大.

 阅读快车系列答案
阅读快车系列答案③酸性KMnO4溶液可将NO2-氧化为NO3-,MnO4-还原成Mn2+.
Ⅰ.产品制备与检验:用如图1装置制备NaNO2:
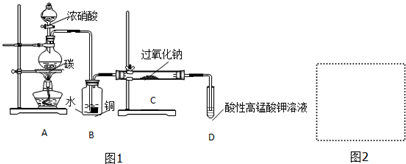
(1)写出装置A烧瓶中发生反应的化学方程式并标出电子转移的方向和数目

(2)B装置的作用是将NO2转化为NO,同时Cu与稀硝酸反应生成NO(或制取NO)
(3)有同学认为装置C中产物不仅有亚硝酸钠,还有硝酸钠、碳酸钠、氢氧化钠,为制备纯净NaNO2应在B、C装置间增加一个装置,请在右框内画出增加的装置图2,并标明盛放的试剂.
(4)试设计实验检验装置C中NaNO2的存在(写出操作、现象和结论)取少量装置C中产物置于试管中,加入适量蒸馏水溶解,(加入稀硫酸酸化)滴加入1-2滴(少量)酸性KMnO4溶液,若溶液紫色褪去,说明C中产物含有NaNO2
Ⅱ.含量的测定
称取装置C中反应后的固体4.00g溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol/L酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
A.酸式滴定管用蒸馏水洗净后未用标准液润洗 B.锥形瓶洗净后未干燥
C.滴定结束仰视读数 D.滴定结束俯视读数
(6)根据表中数据,计算所得固体中亚硝酸钠的质量分数86.25%或0.8625(结果保留4位有效数字)
①金属性最强的是铯
②氧化性最强的是锂离子
③在自然界中均以化合态形式存在
④Li的密度最小,熔点最高
⑤铯与水反应十分剧烈,甚至会发生爆炸
⑥它们的氧化物都只有M2O和M2O2两种形式
⑦粒子半径:Rb+>K+>Na+,Cs>Cs+.
| A. | ①②③④ | B. | ④⑤⑥⑦ | C. | ②⑥ | D. | ①②③④⑤⑦ |
| A. | 用湿润的红色石蕊试纸检验某种气体是否是NH3 | |
| B. | 某种有色溶液可使淀粉-KI试纸变蓝色,则该溶液中可能含有Fe3+ | |
| C. | 用玻璃棒蘸取溶液点在用蒸馏水湿润过的pH试纸上可测量该溶液的pH | |
| D. | 将湿润的蓝色石蕊试纸片粘在玻璃棒上置于氯气中,试纸先变红后褪色 |
| A. | 0.10 mol•L-1AgNO3溶液 | B. | 0.10 mol•L-1ZnSO4溶液 | ||
| C. | 0.20 mol•L-1CuCl2溶液 | D. | 0.20 mol•L-1Mg(NO3)2溶液 |
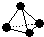 ,已知断裂1mol B-B键吸收167kJ的热量,生成1mol B≡B键放出942kJ热量.试判断相同条件下B4与B2的稳定性顺序是:N4<N2.
,已知断裂1mol B-B键吸收167kJ的热量,生成1mol B≡B键放出942kJ热量.试判断相同条件下B4与B2的稳定性顺序是:N4<N2.
 铁是日常生活中用途最广、用量最大的金属材料.
铁是日常生活中用途最广、用量最大的金属材料.