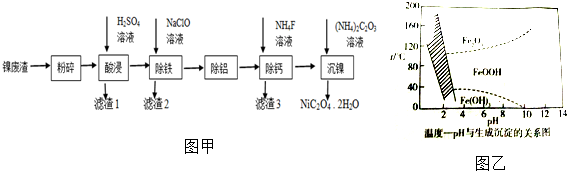
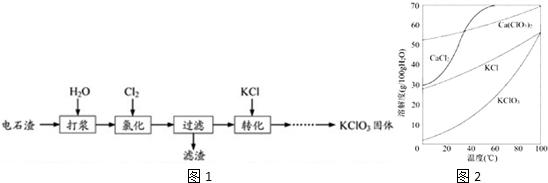
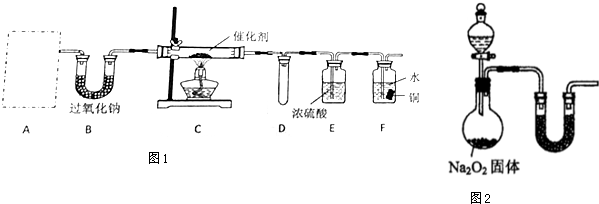
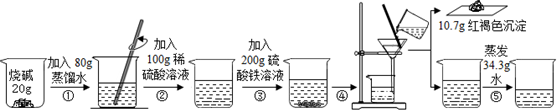
题目内容
11.下列各组离子在指定的溶液中能大量共存的是( )①无色溶液中:K+、Cu2+、Na+、SO42-
②pH=11的溶液中:CO32-、Na+、AlO2-、NO3-
③加入Al能放出H2的溶液中:Cl-、HCO3-、NO3-、NH4+
④在由水电离出的c(OH-)=10-13mol•L-1的溶液中:Na+、Ba2+、Cl-、I-
⑤能使红色石蕊试纸变为蓝色的溶液:Na+、Cl-、S2-、HCO3-
⑥酸性溶液中:Fe2+、Al3+、NO3-、Cl-.
| A. | ①②⑤ | B. | ②④ | C. | ②④⑥ | D. | ③⑤⑥ |
分析 ①无色溶液中不存在有色的铜离子;
②pH=11的溶液中存在大量氢氧根离子,四种离子之间不反应,都不与企业广告离子反应;
③加入Al能放出H2的溶液中存在大量氢离子或氢氧根离子,碳酸氢根离子、铵根离子与氢氧根离子反应,碳酸氢根离子还与氢离子反应;
④在由水电离出的c(OH-)=10-13mol•L-1的溶液中存在大量氢离子或氢氧根离子,四种离子之间不反应,都不与氢离子、氢氧根离子反应;
⑤能使红色石蕊试纸变为蓝色的溶液中存在大量氢氧根离子,碳酸氢根离子与氢氧根离子反应;
⑥酸性溶液中,Fe2+、NO3-发生氧化还原反应.
解答 解:①无色溶液中不能存在有色的Cu2+,故①错误;
②pH=11的溶液呈碱性,CO32-、Na+、AlO2-、NO3-之间不反应,都不与氢氧根离子反应,在溶液中能够大量共存,故②正确;
③加入Al能放出H2的溶液呈酸性或强碱性,HCO3-与氢离子反应,HCO3-、NH4+与氢氧根离子反应,在溶液中不能大量共存,故③错误;
④在由水电离出的c(OH-)=10-13mol•L-1的溶液呈酸性或碱性,Na+、Ba2+、Cl-、I-之间不反应,都不与氢离子、氢氧根离子反应,在溶液中能够大量共存,故④正确;
⑤能使红色石蕊试纸变为蓝色的溶液呈碱性,溶液中存在大量氢氧根离子,HCO3-与氢氧根离子反应,在溶液中不能大量共存,故⑤错误;
⑥酸性溶液中,NO3-具有强氧化性,能够氧化Fe2+,在溶液中不能大量共存,故⑥错误;
故选B.
点评 本题考查离子共存的正误判断,为高考的高频题,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”等.

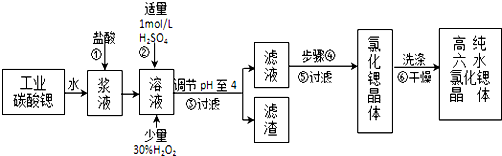
已知:Ⅰ.SrCl2•6H2O晶体在61℃时开始失去结晶水,100℃时失去全部结晶水.
Ⅱ.有关氢氧化物开始沉淀和完全沉淀的pH表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+,其离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)在步骤②-③的过程中,将溶液的pH值由1调节至4时,宜用的试剂为B.
A.氨水 B.氢氧化锶粉末 C. 氢氧化钠 D.碳酸钠晶体
(4)操作③中所得滤渣的主要成分是Fe(OH)3、BaSO4 (填化学式).
(5)工业上完成操作③常用的设备有:B.
A分馏塔 B 离心机 C 热交换器 D 反应釜
(6)工业上用热风吹干六水氯化锶,适宜的温度是B.
A.40~50℃B.50~60℃C.60~70℃D.80℃以上.
(7)已知工业流程中锶的利用率为90%根据以上数据计算工业碳酸锶的纯度:$\frac{1480a}{267W×9}$×100%.
| A. | ①②③④ | B. | ②③④① | C. | ②①③④ | D. | ④②③① |
| A. | 氨水稀释后,溶液中$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$的值减小 | |
| B. | 0.1 mol•L-1Na2CO3溶液加蒸馏水稀释,CO32-的水解程度增大,溶液的pH减小 | |
| C. | 电解精炼铜过程中,阳极质量的减少与阴极质量的增加一定相等 | |
| D. | 298 K时,2H2S(g)+SO2(g)═3S(s)+2H2O(l)能自发进行,则其△H<0 |