题目内容
16. (1)有两种气体单质Am和Bn.已知7.2g Am和6.3g Bn所含的原子个数相同,分子个数之比却为2:3.又知A原子中L电子层含电子数是K电子层的3倍.通过计算回答:写出B的元素名称氮
(1)有两种气体单质Am和Bn.已知7.2g Am和6.3g Bn所含的原子个数相同,分子个数之比却为2:3.又知A原子中L电子层含电子数是K电子层的3倍.通过计算回答:写出B的元素名称氮(2)向含0.1molFeBr2的溶液中通入0.1molCl2充分反应,反应的离子方程式为2Cl2+2Br-+2Fe2+=Br2+4Cl-+2Fe3+(写成一个离子方程式)
(3)将192克铜投入1L浓度均为2mol/L硝酸、硫酸的混合酸,充分反应生成NO33.6L(标准状态下)(还原产物只有NO)
(4)取100克铜、铁、银、铝金属的混合物,在足量的稀硝酸完全溶解,已知硝酸的还原产物为NO,且NO体积在标准状态下为67.2L;向所得的溶液中加入适量的2mol/L氢氧化钠溶液,则能得到沉淀最大值为253克
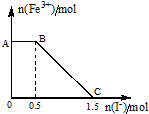
(5)将一定量经硫酸酸化的KMnO4溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,
开始加入的KMnO4的物质的量为0.3mol(附注:高锰酸钾将16H++2MnO4-+10I-=5I2+2Mn2++8H2O)
分析 (1)根据A原子的L层电子数是K层的3倍,可推知A是氧元素,计算A原子的物质的量,根据含有原子数目相等,可以得到B原子物质的量,进而计算B元素的摩尔质量,确定B元素;
(2)1molFeBr2的溶液中通入1molCl2,先与亚铁离子反应,再与溴离子反应;
(3)n(HNO3)=2mol/L×1L=2mol、n(H2SO4)=2mol/L×1L=2mol,n(H+)=n(HNO3)+2n(H2SO4)=2mol+2mol×2=6mol,n(Cu)=$\frac{192g}{64g/mol}$=3mol,发生反应为 3Cu+2NO3-+8H+=3Cu2++2NO+4H2O,根据方程式知,2mol硝酸根离子完全反应需要n(H+)为8mo>6mol、n(Cu)为3mol,所以氢离子不足量,根据氢离子计算NO的体积;
(4)铜、铁、银、铝金属的混合物,在足量的稀硝酸完全溶解,已知硝酸的还原产物为NO,且NO体积在标准状态下为67.2L;向所得的溶液中加入适量的2mol/L氢氧化钠溶液,生成氢氧化物沉淀,其中氢氧根离子物质的量和金属失去的电子物质的量相同,即为硝酸钡还原生成一氧化氮得到的电子数,金属氢氧化物的质量=金属质量+氢氧根离子质量;
(5)酸化的KMnO4溶液与FeSO4溶液混合后发生氧化还原反应,可知氧化性KMnO4>Fe3+;由图象可知,在反应后的溶液中滴加碘化钾溶液,开始时Fe3+浓度不变,则说明Fe3+没有参加反应,则AB应为高锰酸钾和碘化钾的反应,BC段为铁离子和碘化钾的反应,结合得失电子守恒解答该题.
解答 解:(1)根据A原子的L层电子数是K层的3倍,可推知A是氧元素,Am中含A原子的物质的量为$\frac{7.2g}{16g/mol}$=0.45 mol,则Bn中含B原子数也为0.45 mol,B元素的原子的摩尔质量=$\frac{6.3g}{0.45mol}$=14g/mol,故B元素为氮元素,
故答案为:氮;
(2)0.11molFeBr2的溶液中通入0.11molCl2,先与亚铁离子反应,再与溴离子反应,其反应的离子方程式为2Cl2+2Br-+2Fe2+=Br2+4Cl-+2Fe3+;
故答案为:2Cl2+2Br-+2Fe2+=Br2+4Cl-+2Fe3+;
(3)n(HNO3)=2mol/L×1L=2mol、n(H2SO4)=2mol/L×1L=2mol,n(H+)=n(HNO3)+2n(H2SO4)=2mol+2mol×2=6mol,n(Cu)=$\frac{192g}{64g/mol}$=3mol,发生反应为 3Cu+2NO3-+8H+=3Cu2++2NO+4H2O,根据方程式知,2mol硝酸根离子完全反应需要n(H+)为8mo>6mol、n(Cu)为3mol,所以氢离子不足量,根据氢离子计算NO的体积,6molH+反应生成NO物质的量=$\frac{2}{8}$×6=1.5mol,标准状况下气体体积=1.5mol×22.4L/mol=33.6L,
故答案为:33.6L;
(4)铜、铁、银、铝金属的混合物,在足量的稀硝酸完全溶解,已知硝酸的还原产物为NO,且NO体积在标准状态下为67.2L,物质的量=$\frac{67.2L}{22.4L/mol}$=3mol,HNO3~NO~3e-,电子转移总数为3mol×3=9mol,向所得的溶液中加入适量的2mol/L氢氧化钠溶液,生成氢氧化物沉淀,其中氢氧根离子物质的量和金属失去的电子物质的量相同,即为硝酸钡还原生成一氧化氮得到的电子数,则氢氧根离子物质的量=9mol,金属氢氧化物沉淀的质量=金属质量+氢氧根离子质量=100g+9mol×17g/mol=253g,
故答案为:253;
(5)酸化的KMnO4溶液与FeSO4溶液混合后发生氧化还原反应,可知氧化性KMnO4>Fe3+,当加入KI时,Fe3+的量开始一段时间不变,是因为I-还原了剩余的MnO4-,故图中AB段发生的是过量的酸性KMnO4溶液与KI的反应,Fe3+的物质的量不断减少,说明I-还原了Fe3+,BC段为Fe3+与Fe2+的混合液,据电子守恒有MnO4-~~5I-,故剩余的KMnO4的物质的量为0.1mol,据电子守恒有MnO4-~~5Fe2+~~5Fe3+~~5I-,故与Fe2+的KMnO4的物质的量为0.2mol,故原来KMnO4的物质的量为0.3mol,
故答案为:0.3mol.
点评 本题考查化学方程式的计算、氧化还原反应定量计算和判断,侧重于学生的分析能力和计算能力的考查,为高考常见题型和高频考点,注意把握反应的相关方程式的书写,根据方程式、关系式计算该题,题目难度中等.

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案| A. | 用湿润的红色石蕊试纸检验某种气体是否是NH3 | |
| B. | 某种有色溶液可使淀粉-KI试纸变蓝色,则该溶液中可能含有Fe3+ | |
| C. | 用玻璃棒蘸取溶液点在用蒸馏水湿润过的pH试纸上可测量该溶液的pH | |
| D. | 将湿润的蓝色石蕊试纸片粘在玻璃棒上置于氯气中,试纸先变红后褪色 |
| A. | 氨水稀释后,溶液中$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$的值减小 | |
| B. | 0.1 mol•L-1Na2CO3溶液加蒸馏水稀释,CO32-的水解程度增大,溶液的pH减小 | |
| C. | 电解精炼铜过程中,阳极质量的减少与阴极质量的增加一定相等 | |
| D. | 298 K时,2H2S(g)+SO2(g)═3S(s)+2H2O(l)能自发进行,则其△H<0 |
| A. | 0.10 mol•L-1AgNO3溶液 | B. | 0.10 mol•L-1ZnSO4溶液 | ||
| C. | 0.20 mol•L-1CuCl2溶液 | D. | 0.20 mol•L-1Mg(NO3)2溶液 |
| A. | Na2CO3和NaHCO3粉末与同浓度的盐酸时,Na2CO3因为碱性强,所以与盐酸反应放出气体速度快 | |
| B. | 等物质的量的两种盐与同浓度的盐酸反应,Na2CO3所消耗盐酸的体积是 NaHCO3的两倍 | |
| C. | 向Na2CO3饱和溶液中通人过量CO2,有NaHCO3结晶析出 | |
| D. | Na2CO3和NaHCO3溶液分别和BaCl2溶液反应,现象不同 |
 .
. .
.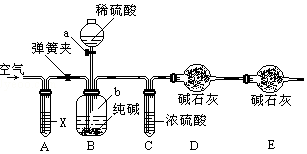 某纯碱样品中含有少量氯化钠杂质,现用如图所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等在图中均已略去).实验步骤如下:
某纯碱样品中含有少量氯化钠杂质,现用如图所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等在图中均已略去).实验步骤如下: