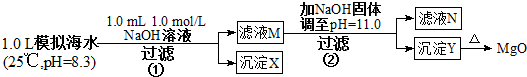
题目内容
下列有关电解质溶液中微粒的物质的量浓度的关系正确的是( )
| A、向0.1 mol?L-1NH4 Cl溶液中通入一定量氨气:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| B、将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后的溶液中:c(Na+)<c(Cl-) |
| C、已知Ka(HF)=7.2×10-4,Ka(HCN)=4.9×10-10,等体积等浓度的NaF、NaCN溶液中,前者离子总数小于后者 |
| D、浓度均为0.1mol?L-l的三种溶液中:①(NH4)2CO3、②(NH4)2 SO4、③(NH4)2Fe(SO4)2,c(NH4+)的大小顺序为:③>②>① |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:A.没有告诉溶液的酸碱性,无法判断溶液中各离子浓度大小;
B.溶液为中性,则:c(OH-)=c(H+),根据电荷守恒判断钠离子与氯离子浓度大小;
C.Ka越小,对应盐的水解程度越大,其离子总数就小;
D.①相互促进水解,②中只有铵根离子水解,③中亚铁离子水解生成的氢离子抑制铵根离子水解.
B.溶液为中性,则:c(OH-)=c(H+),根据电荷守恒判断钠离子与氯离子浓度大小;
C.Ka越小,对应盐的水解程度越大,其离子总数就小;
D.①相互促进水解,②中只有铵根离子水解,③中亚铁离子水解生成的氢离子抑制铵根离子水解.
解答:
解:A.向0.1 mol?L-1NH4Cl溶液中通入一定量氨气,溶液可能为碱性、中性或酸性,由于无法判断溶液酸碱性,则无法判断溶液中离子浓度大小,故A错误;
B.将醋酸钠、盐酸两溶液混合后,溶液呈中性,则:c(OH-)=c(H+),根据电荷守恒c(OH-)+c(CH3COO-)+c(Cl-)=c(Na+)+c(H+)可得:c(CH3COO-)+c(Cl-)=c(Na+),则c(Na+)>c(Cl-),故B错误;
C.Ka越小,对应盐的水解程度越大,其离子总数就小,则等体积等浓度的NaF、NaCN溶液中,前者离子总数大于后者,故C错误;
D.①相互促进水解,②中只有铵根离子水解,③中亚铁离子水解生成的氢离子抑制铵根离子水解,则c(NH4+)的大小顺序为:③>②>①,故D正确;
故选D.
B.将醋酸钠、盐酸两溶液混合后,溶液呈中性,则:c(OH-)=c(H+),根据电荷守恒c(OH-)+c(CH3COO-)+c(Cl-)=c(Na+)+c(H+)可得:c(CH3COO-)+c(Cl-)=c(Na+),则c(Na+)>c(Cl-),故B错误;
C.Ka越小,对应盐的水解程度越大,其离子总数就小,则等体积等浓度的NaF、NaCN溶液中,前者离子总数大于后者,故C错误;
D.①相互促进水解,②中只有铵根离子水解,③中亚铁离子水解生成的氢离子抑制铵根离子水解,则c(NH4+)的大小顺序为:③>②>①,故D正确;
故选D.
点评:本题考查离子浓度大小的比较,为高频考点,把握盐类水解、水解的促进和抑制及电荷守恒式为解答的关键,选项C为解答的易错点,题目难度中等.

练习册系列答案
相关题目
下列实验操作中不正确的是( )
| A、分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| B、氢气还原氧化铜实验中先通氢气再加热实验结束时应先停止加热,继续通氢气至固体冷却 |
| C、配制浓硫酸与蒸馏水的混合液时,应将浓硫酸慢慢加到蒸馏水中并及时搅拌和冷却 |
| D、用胶头滴管向试管中加入液体时,为防止滴在试管外面,应将滴管尖嘴处伸入试管口中 |
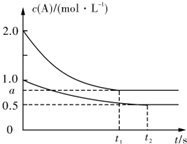 向甲、乙两恒温恒容的密闭容器中分别充入一定量的A和B,发生反应:
向甲、乙两恒温恒容的密闭容器中分别充入一定量的A和B,发生反应:A(g)+B(g)?xC(g)△H<O.测得两容器中c(A)随时间t的变化如图所示:下列说法正确的是( )
| 容器 | 甲 | 乙 |
| 容积(L) | 0.5 | 0.5 |
| 反应放热(kJ) | Q1 | Q2 |
| 反应物起始量 | 1molA 1molB | 0.5molA 0.5molB |
| A、x=1 |
| B、Q1<2Q2 |
| C、根据题中信息无法计算a值 |
| D、保持其他条件不变,起始时向乙容器充人0.2mol A、0.2mol B、0.2mol C,则此时v(正)>v(逆) |
将20mL0.4mol?L-1硝酸铵溶液跟50mL0.1mol?L-1氢氧化钡溶液混合,则混合溶液中各离子浓度的大小顺序是( )
| A、[NO3-]>[OH-]>[NH4+]>[Ba2+] |
| B、[NO3-]>[Ba2+]>[OH-]>[NH4+] |
| C、[Ba2+]>[NO3-]>[OH-]>[NH4+] |
| D、[NO3-]>[Ba2+]>[NH4+]>[OH-] |
关于食物的酸碱性说法错误的是( )
| A、蛋白质在体内经消化后生成碳酸、硫酸、尿酸等,故它属于酸性食物 |
| B、葡萄吃起来是酸的,故它属于酸性食物 |
| C、食物的酸碱性与化学上所指溶液的酸碱性不同的 |
| D、正常情况下,人体血液的pH总保持弱碱性范围 |
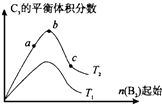 已知2A2(g)+B2(g)?2C3(g);△H=-Q1 kJ/mol(Q1>0),在一个有催化剂的固定容积的容器中加入2molA2和1molB2,在500℃时充分反应,达平衡后C3的浓度为w mol?L-1,放出热量为Q2 kJ.
已知2A2(g)+B2(g)?2C3(g);△H=-Q1 kJ/mol(Q1>0),在一个有催化剂的固定容积的容器中加入2molA2和1molB2,在500℃时充分反应,达平衡后C3的浓度为w mol?L-1,放出热量为Q2 kJ.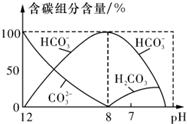 在含有弱电解质的溶液中,往往有多个化学平衡共存.
在含有弱电解质的溶液中,往往有多个化学平衡共存.