题目内容
1. 如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:(1)该浓硫酸的物质的量浓度为18.4 mol/L.
(2)取用任意体积的该硫酸溶液时,下列物理量中不随所取体积的多少而变化的是BD
A.溶液中H2SO4的物质的量 B.溶液的浓度
C.溶液中SO42-的数目 D.溶液的密度
(3)某学生欲用上述浓硫酸和蒸馏水配制480mL物质的量浓度为0.2mol/L稀硫酸.
①该学生需要量取5.4 mL上述浓硫酸进行配制.
②配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)BCAFED;
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需浓硫酸的体积,慢慢沿杯壁注入盛有少量水(约30mL)的烧杯中,用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的硫酸沿玻璃棒注入一定体积的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1~2cm处.
分析 (1)该溶液物质的量浓度=$\frac{1000ρω}{M}$;
(2)溶液密度、物质的量浓度与溶液体积无关,溶液中溶质物质的量、微粒数都与体积有关;
(3)①根据溶液稀释前后溶质的物质的量不变计算所需浓硫酸的体积,应注意的是由于无480mL容量瓶,故应选择500mL容量瓶,则配制出500mL溶液;
②根据配制一定物质的量浓度溶液的步骤是计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶来分析.
解答 解:(1)该溶液物质的量浓度=$\frac{1000ρω}{M}$=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,
故答案为:18.4;
(2)A.根据n=cV知,溶质的物质的量与溶液体积有关,故A不选;
B.溶液是均一稳定的,物质的量浓度与溶液体积无关,故B选;
C.根据N=cVNA知,溶液中硫酸根离子个数与溶液体积有关,故C不选;
D.溶液是均一稳定的,密度与溶液体积无关,故D选;
故选BD;
(3)①由于无480mL容量瓶,故应选择500mL容量瓶,则配制出500mL溶液,溶液稀释前后溶质的物质的量不变,则所需浓硫酸体积=$\frac{0.2mol/L×0.5L}{18.4mol/L}$=5.4mL,
故答案为:5.4;
②根据配制一定物质的量浓度溶液的步骤是计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶可知,正确的操作顺序是BCAFED,故答案为:BCAFED;
点评 本题考查一定物质的量浓度溶液配制,侧重考查学生实验操作能力及计算能力,明确操作步骤、误差分析、物质的量浓度计算方法即可解答,易错点是误差分析.

练习册系列答案
相关题目
11.下列有关说法正确的是( )
| A. | 纤维素、蛋白质、油脂都是高分子化合物 | |
| B. | 糖类、蛋白质、油脂都是由C、H、O三种元素组成的 | |
| C. | 油脂有油和脂肪之分,但都属于酯 | |
| D. | 只用淀粉溶液就可鉴别市售食盐是否为加碘盐 |
12.下列实验操作正确且能达到相应实验目的是( )
| 实验目的 | 实验操作 | |
| A | 称取2.0gNaOH固体 | 先在托盘上各放一张滤纸,然后在右盘上添加2g砝码,左盘上添加NaOH固体 |
| B | 制备Fe(OH)3胶体 | 向沸腾的蒸馏水中逐滴加入少量氯化铁饱和溶液,继续加热煮沸至液体变为红褐色 |
| C | 检验溶液中是否含有SO42- | 取少量试液于试管中,先加入BaCl2溶液,再滴加稀盐酸,若产生的白色沉淀不溶解,则说明溶液中含有SO42- |
| D | 萃取碘水中的碘 | 将碘水倒入分液漏斗,然后再注入酒精,振荡,静置分层后,下层液体从下口放出,上层液体从上口倒出 |
| A. | A | B. | B | C. | C | D. | D |
16.下列属于放热的氧化还原反应的是( )
| A. | 二氧化碳与赤热的炭反应生成一氧化碳 | |
| B. | 葡萄糖在人体内氧化 | |
| C. | 生石灰制熟石灰 | |
| D. | Ba(OH)2•8H2O与NH4Cl反应 |
6.下列反应中,氧化剂与还原剂化学计量数为1:2的是( )
| A. | Fe+2HCl═FeCl2+H2↑ | |
| B. | 2HCl+Ca(ClO)2═2HClO+CaCl2 | |
| C. | I2+2NaClO3═2NaIO3+Cl2↑ | |
| D. | 4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O |
13.下列反应中必须加入还原剂才能进行的是( )
| A. | H2O→H2 | B. | Zn→Zn2+ | C. | Fe3+→Fe2+ | D. | CuO→CuCl2 |
 实验室需要0.1mol•L-1 NaOH溶液450mL和0.5mol•L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
实验室需要0.1mol•L-1 NaOH溶液450mL和0.5mol•L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题: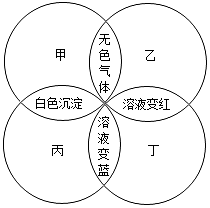 甲、乙、丙、丁分别是石蕊溶液、稀硫酸、碳酸钠溶液、澄清石灰水中的一种,若用四个圆表示四种溶液,两圆相交部分为两溶液混合后出现的主要实验现象,如图所示.请回答:
甲、乙、丙、丁分别是石蕊溶液、稀硫酸、碳酸钠溶液、澄清石灰水中的一种,若用四个圆表示四种溶液,两圆相交部分为两溶液混合后出现的主要实验现象,如图所示.请回答: