题目内容
10.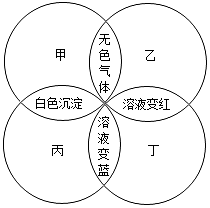 甲、乙、丙、丁分别是石蕊溶液、稀硫酸、碳酸钠溶液、澄清石灰水中的一种,若用四个圆表示四种溶液,两圆相交部分为两溶液混合后出现的主要实验现象,如图所示.请回答:
甲、乙、丙、丁分别是石蕊溶液、稀硫酸、碳酸钠溶液、澄清石灰水中的一种,若用四个圆表示四种溶液,两圆相交部分为两溶液混合后出现的主要实验现象,如图所示.请回答:(1)丁是石蕊溶液;通常其用途为判断溶液的酸碱性.
(2)甲和丙的化学反应方程式为CO32-+Ca2+═CaCO3↓; 反应类型为复分解反应.
分析 (1)根据石蕊溶液是酸碱指示剂,遇到酸和碱呈现不同的颜色考虑本题;
(2)根据方程式的写法和复分解反应的特点考虑.
解答 解:(1)由于石蕊溶液是酸碱指示剂,遇到酸变成红色,遇到碱变成蓝色,再根据图示中丁与乙结合呈现红色,丁与丙结合呈现蓝色,所以丁是酸碱指示剂石蕊试液,所以乙是稀硫酸,因为硫酸与碳酸钠反应生成硫酸钠、水、二氧化碳,所以甲是碳酸钠溶液,丙就是氢氧化钙溶液,石蕊溶液是酸碱指示剂,遇到酸和碱呈现不同的颜色,可以用来判断溶液的酸碱性,
故答案为:石蕊溶液;判断溶液的酸碱性;
(2)由上面的推断可知甲是碳酸钠,丙是氢氧化钙,所以该反应的反应物是碳酸钠和氢氧化钙,生成物是碳酸钙沉淀和氢氧化钠,离子方程式为:CO32-+Ca2+═CaCO3↓,用观察法配平,碳酸钙后面标上沉淀符号;两种化合物相互交换成分生成两种新的化合物的反应,属于复分解反应,该反应符合这一特点,属于复分解反应.
故答案为:CO32-+Ca2+═CaCO3↓;复分解反应.
点评 解答本题关键是要知道石蕊溶液遇到酸变红色,遇到碱变蓝色;要熟悉方程式的写法和复分解反应的特点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.下列说法不正确的是( )
| A. | 道尔顿提出原子学说,门捷列夫发现元素周期律 | |
| B. | 化学研究的主要目的就是认识分子 | |
| C. | 研究物质的性质,常常运用观察、实验、分类、比较等方法 | |
| D. | 化学家可以在微观层面上操纵分子和原子,组装分子材料、分子器件和分子机器 |
18.与0.3molH2O含有相同氢原子数的是( )
| A. | 0.3molHNO3 | B. | 0.2molH3PO4 | ||
| C. | 3.01×1023个HNO3分子 | D. | 0.1molNH3 |
15.如表是生活生产中常见的物质,表中列出了它们的(主要)成分.
(1)请你对表中①~⑦的主要成分进行分类(填编号):属于电解质的是②③④⑦,属于非电解质的是①⑥.
(2)过量②的水溶液与⑦反应的离子方程式2CH3COOH+CO32-=2CH3COO-+CO2↑+H2O.
(3)某同学用⑤和浓硫酸共热来制备⑥,化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O
①请用双线桥标出电子转移的方向和数目;
②被氧化与未被氧化的H2SO4的物质的量之比为1:1,当电子转移0.1mol时,消耗还原剂的质量为3.2g.
(4)如图表示某同学配制480mL0.5mol/L的NaOH溶液的部分操作示意图,其中有错误的是C,这样操作所配制的溶液比要求的浓度要偏低 (填“偏高”、“偏低”、“不影响”).配制应称取10.0gNaOH.

| 编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
| 名称 | 酒精 | 醋酸 | 火碱 | 食盐 | 铜导线 | 亚硫酸酐 | 苏打 |
| 主要成分 | CH3CH2OH | CH3COOH | NaOH | NaCl | Cu | SO2 | Na2CO3 |
(2)过量②的水溶液与⑦反应的离子方程式2CH3COOH+CO32-=2CH3COO-+CO2↑+H2O.
(3)某同学用⑤和浓硫酸共热来制备⑥,化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O
①请用双线桥标出电子转移的方向和数目;
②被氧化与未被氧化的H2SO4的物质的量之比为1:1,当电子转移0.1mol时,消耗还原剂的质量为3.2g.
(4)如图表示某同学配制480mL0.5mol/L的NaOH溶液的部分操作示意图,其中有错误的是C,这样操作所配制的溶液比要求的浓度要偏低 (填“偏高”、“偏低”、“不影响”).配制应称取10.0gNaOH.

 如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题: .
. (1)已知如图所示的可逆反应:
(1)已知如图所示的可逆反应: