题目内容
13.下列反应中必须加入还原剂才能进行的是( )| A. | H2O→H2 | B. | Zn→Zn2+ | C. | Fe3+→Fe2+ | D. | CuO→CuCl2 |
分析 变化中某元素的化合价降低,发生还原反应,则一般需要加入还原剂才能实现氧化还原反应.注意通过分解反应可以实现的,不一定需要加入还原剂,以此解答该题.
解答 解:A.可通过电解生成,无需加入还原剂,故A错误;
B.Zn元素化合价升高,被氧化,应加入氧化剂,故B错误;
C.Fe元素化合价降低,被还原,应加入还原剂,故C正确;
D.元素化合价没有变化,可通过复分解反应生成,故D错误.
故选C.
点评 本题考查氧化还原反应,明确元素的化合价降低时物质被还原、元素的化合价升高时被氧化是解答本题的关键,注意注意通过分解反应可以实现的,不一定需要加入还原剂或氧化剂,题目难度不大.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
4.在理论上不能用于设计原电池的化学反应是( )
| A. | HCl(aq)+NaOH (aq)═NaCl (aq)+H2O (l)△H<0 | |
| B. | 2CH3OH (l)+3O2 (g)═2CO2 (g)+4H2O (l)△H<0 | |
| C. | 2FeCl3(aq)+Fe(s)═3FeCl3(aq)△H<0 | |
| D. | 2H2(g)+O2(g)═2H2O (l)△H<0 |
18.与0.3molH2O含有相同氢原子数的是( )
| A. | 0.3molHNO3 | B. | 0.2molH3PO4 | ||
| C. | 3.01×1023个HNO3分子 | D. | 0.1molNH3 |
11.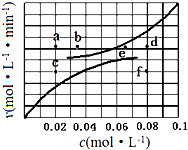 在1.0L密闭容器中放入0.10molA(g),在一定温度进行如下反应:
在1.0L密闭容器中放入0.10molA(g),在一定温度进行如下反应:
A(g)?B(g)+C(g)△H=+285.1kJ•mol-1
反应时间(t)、容器内气体总压强(P)和A的物质的量浓度的数据见下表:
回答下列问题:
(1)上述反应能够自发进行的条件是高温.
(2)由总压强P和起始压强P0表示反应物A的转化率α(A)的表达式为($\frac{P}{{P}_{0}}$-1)×100%.根据表中数据计算平衡时A的转化率为73.9%.
(3)用气体的平衡分压(分压=总压×物质的量的分数)代替平衡浓度表示该反应的平衡常数的表达式KP=$\frac{{α}^{2}(A)}{[1+α(A)]×[1-α(A)]}P$(用含α(A)和P的式子表示).
(4)由总压强P和起始压强P0表示反应体系的总物质的量n总和反应物A的物质的量n(A),
n总=0.1×$\frac{P}{{P}_{0}}$mol,n(A)=0.1×(2-$\frac{P}{{P}_{0}}$)mol,根据上表计算a=0.026mol/L.
(5)由上述实验数据得到反应速率与反应物和生成物物质的量浓度的关系可用图表示.当升高到某一温度时反应重新达到平衡,相应的点分别为a、d.
 在1.0L密闭容器中放入0.10molA(g),在一定温度进行如下反应:
在1.0L密闭容器中放入0.10molA(g),在一定温度进行如下反应:A(g)?B(g)+C(g)△H=+285.1kJ•mol-1
反应时间(t)、容器内气体总压强(P)和A的物质的量浓度的数据见下表:
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 |
| 总压强p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 8.54 |
| c(A)/(mol•L-1) | 0.10 | 0.086 | 0.071 | 0.051 | a | a |
(1)上述反应能够自发进行的条件是高温.
(2)由总压强P和起始压强P0表示反应物A的转化率α(A)的表达式为($\frac{P}{{P}_{0}}$-1)×100%.根据表中数据计算平衡时A的转化率为73.9%.
(3)用气体的平衡分压(分压=总压×物质的量的分数)代替平衡浓度表示该反应的平衡常数的表达式KP=$\frac{{α}^{2}(A)}{[1+α(A)]×[1-α(A)]}P$(用含α(A)和P的式子表示).
(4)由总压强P和起始压强P0表示反应体系的总物质的量n总和反应物A的物质的量n(A),
n总=0.1×$\frac{P}{{P}_{0}}$mol,n(A)=0.1×(2-$\frac{P}{{P}_{0}}$)mol,根据上表计算a=0.026mol/L.
(5)由上述实验数据得到反应速率与反应物和生成物物质的量浓度的关系可用图表示.当升高到某一温度时反应重新达到平衡,相应的点分别为a、d.
 如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题: .
.