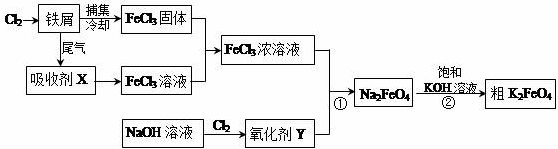
题目内容
7.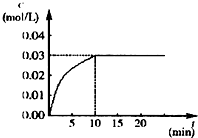 在某一容积为5L的密闭容器内,加入 0.2mol的CO和0.2mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g),△H<0,反应中CO2的浓度随时间变化情况如图:
在某一容积为5L的密闭容器内,加入 0.2mol的CO和0.2mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g),△H<0,反应中CO2的浓度随时间变化情况如图:(1)根据图中数据计算反应开始至达到平衡时CO的化学反应速率为v(CO)=0.003mol/L•min;若升高温度,则化学平衡常数K减小(填“增大”“减小”或“不变”).
(2)如要一开始加入0.1mol的CO、0.1mol的H2O、0.1mol的CO2和0.1mol的H2,在相同的条件下,反应CO(g)+H2O(g)?CO2(g)+H2(g)向正反应 (填“正反应”或“逆反应”)方向进行,其依据是浓度商Qc=$\frac{0.1×0.1}{0.1×0.1}$=1<k=9,反应正反应方向进行.反应达平衡时,c(H2O)=0.01mol/L.
分析 (1)根据CO2的浓度变化求出CO的浓度变化,再求反应速率V=$\frac{△c}{△t}$,反应是放热反应,升温平衡逆向进行;
(2)根据平衡常数指各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,计算此时的浓度商和平衡常数比较大小判断反应进行的方向,依据化学平衡三行计算得到平衡状态下水的浓度.
解答 解:(1)CO(g)+H2O(g)?CO2(g)+H2(g),△H<0,二氧化碳浓度变化为0.03mol/L•min,则一氧化碳消耗浓度为0.03mol/L•min,
以一氧化碳表示的反应速率v(CO)=$\frac{△c}{△t}$=$\frac{0.03mol/L•min}{10min}$=0.003mol/L•min,反应是放热反应,升温平衡逆向进行,平衡常数减小,
故答案为:0.003mol/L•min,减小;
(2)依据化学三行计算列式计算平衡浓度,计算得到平衡常数,c(CO)=c(H2O)=$\frac{0.2mol}{5L}$=0.04mol/L,
CO(g)+H2O(g)?CO2(g)+H2(g),
起始量(mol/L) 0.04 0.04 0 0
变化量(mol/L) 0.03 0.03 0.03 0.03
平衡量(mol/L) 0.01 0.01 0.03 0.03
K=$\frac{0.03×0.03}{0.01×0.01}$=9,
如要一开始加入0.1mol的CO、0.1mol的H2O、0.1mol的CO2和0.1mol的H2,浓度商Qc=$\frac{0.1×0.1}{0.1×0.1}$=1<k=9,反应正反应方向进行,
CO(g)+H2O(g)?CO2(g)+H2(g),设达到平衡状态,反应消耗一氧化碳浓度为x,
起始量(mol/L) 0.02 0.02 0.02 0.02
变化量(mol/L) x x x x
平衡量(mol/L) 0.02-x 0.02-x 0.02+x 0.02+x
$\frac{(0.02+x)^{2}}{(0.02-x)^{2}}$=K=9
x=0.01mol/L,
平衡状态下,c(H2O)=0.02mol/L-0.01mol/L=0.01mol/L,
故答案为:正反应,浓度商Qc=$\frac{0.1×0.1}{0.1×0.1}$=1<k=9,反应正反应方向进行,0.01mol/L.
点评 本题考查了反应速率的计算、化学平衡有关计算、化学平衡移动与影响因素、K的应用等,注意把握平衡常数的应用、平衡移动的本质是解答的关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | CH3Cl | B. | CH2Cl2 | C. | CHCl3 | D. | HCl |
| A. | +2 | B. | +3 | C. | +4 | D. | +5 |
| A. | KOH溶液与AlCl3溶液 | B. | AlCl3溶液与氨水 | ||
| C. | NaAlO2溶液与盐酸 | D. | NaHCO3溶液与盐酸 |
| A. | 0.1mol/L | B. | 0.2mol/L | C. | 0.3mol/L | D. | 0.4mol/L |
| A. | H2SO4、HClO、BaCO3是电解质 | |
| B. | 生石灰与水混合发生化学、物理变化 | |
| C. | 丁达尔效应可以区分溶液与胶体 | |
| D. | 光导纤维中所用材料为晶体硅 |
| A. | HCl | B. | Fe3+ | C. | Al3+ | D. | Cl- |